Формулы давления газов идеального и реального. Давление смеси идеальных газов

Агрегатное состояние вещества, которое не способно сохранять свой объем и форму в открытом пространстве при воздействии малых внешних сил, называется газом. Существует четыре макроскопических параметра газа, которые можно измерить и вычислить. Одним из них является давление. В приведенной ниже статье изучим вопрос, с помощью каких формул давление газа можно вычислить.
Что такое давление?
В физике под давлением понимают величину, равную отношению механической силы F, которая перпендикулярно воздействует на поверхность некоторой площади S, то есть:
P = F / S.
Из равенства следует, что измеряться величина P должна в ньютонах на квадратный метр (Н/м2). В СИ эта единица называется паскалем (1 Па = 1 Н/м2).
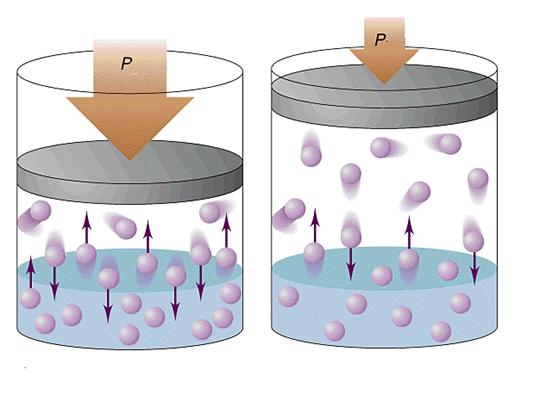
В случае газов давление возникает за счет столкновений со стенками сосудов газовых частиц. Последние могут быть атомами или сложными молекулами. В любом газе частицы хаотично движутся в разных направлениях. Их столкновение со стенкой сосуда приводит к передаче последней некоторого количества движения, что создает эффект воздействующей силы. Так как число сталкивающихся со стенкой частиц является огромным, то в среднем они создают некоторое постоянное давление, которое может быть измерено на практике при помощи барометра или манометра.
Идеальные и реальные газы
Каждому школьнику известно свойство газа, согласно которому он может занимать любой предоставленный ему объем. Если проверить это свойство на практике, то окажется, что оно практически никогда не выполняется: наступает момент, когда газ перестает расширяться, хотя возможность для этого присутствует. Связан этот факт с наличием межмолекулярных взаимодействий в газах.
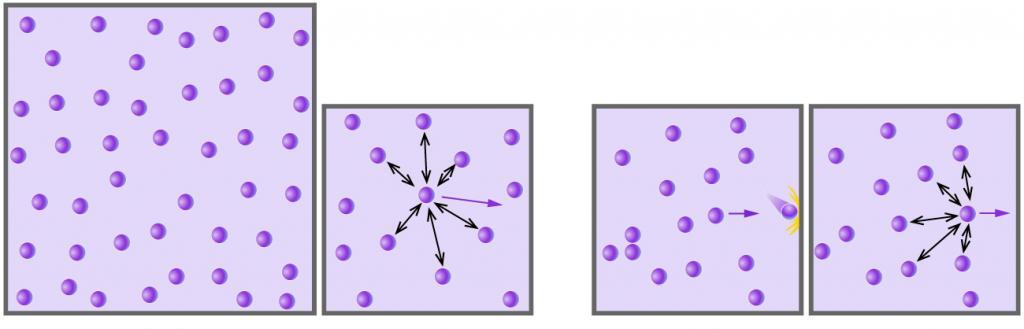
Концепция идеального газа базируется на двух важных условиях:
- Газ будет идеальным, если потенциальная энергия его частиц на несколько порядков меньше средней кинетической энергии. В этом случае межмолекулярными взаимодействиями пренебрегают.
- Газ называют идеальным, если размеры частиц намного меньше расстояний между ними. В противном случае увеличивается вероятность столкновения частиц, а значит, вероятность их химического взаимодействия.
Изложенное выше можно резюмировать следующим образом: газовое состояние можно считать идеальным только при низких давлениях (плотностях), высоких температурах и высокой химической инертности составляющих частиц.
Если указанные условия не выполняются, то математическое описание поведения газов отличается от идеального.
Формулы давления газа (идеального)

В 1834 году в результате анализа экспериментальных данных относительно поведения газовых систем при различных условиях (законы Бойля-Мариотта, Гей-Люссака, Шарля, принцип Авогадро) французский инженер и ученый Эмиль Клапейрон вывел универсальное уравнение идеального газа. Впоследствии оно было несколько модифицировано русским химиком Менделеевым. В настоящее время его записывают так:
P * V = n * R * T.
Здесь n, T и V - количество вещества, абсолютная температура и объем газа. Постоянная R равна 8,314 Дж/(К*моль).
Это уравнение позволяет записать формулу абсолютного давления газа в следующем виде:
P = n * R * T / V.
Из этой формулы следует, что если происходит изотермический процесс в закрытой системе, то давление будет меняться обратно пропорционально величине V (закон Бойля-Мариотта). Если же объем в закрытой системе зафиксировать, то P будет линейно расти с увеличением абсолютной температуры (закон Гей-Люссака).
Помимо записанного выражения, можно привести еще одну формулу давления газа, объем которого изменяется. Эта формула следует из молекулярно-кинетической теории. Запишем ее:
P = N * m * v2 / (3 * V).
Где N, m - число частиц и масса одной частицы, v2 - квадрат средней скорости.
Обе формулы легко переводятся друг в друга, если использовать следующее выражение связи кинетической энергии частицы и абсолютной температуры:
m * v2 / 2 = 3 / 2 *kB * T.
Здесь постоянная Больцмана обозначена kB.
Давление смеси идеальных газов
Ярким примером такой смеси является воздух. Для определения давления смеси применяют на практике закон Дальтона, который гласит, что создаваемые каждым компонентом смеси давления парциальные в сумме дают абсолютное давление. В свою очередь парциальное давление компонента прямо пропорционально его атомной доли в смеси. Формула абсолютного давления газа из j компонент принимает вид:
P = R * T / V * ∑i=1j(ni).
Заметим, что в газовой смеси все компоненты находятся при одинаковой температуре и занимают один и тот же объем.
Давление в реальных газах

Как выше было сказано, давление легко измерить, используя соответствующий прибор. Однако для газов, поведение которых значительно отклоняется от идеального (алканы с длинными углеродными цепями, водяной пар), можно с высокой точностью рассчитать давление, если использовать уравнение состояния Ван-дер-Ваальса. Оно имеет форму:
(P + α * n2 / V2) * (V - n * β) = n * R * T.
Нетрудно увидеть, что это уравнение является модифицированным вариантом закона Клапейрона-Менделеева. Здесь α и β представляют собой некоторые числа, которые зависят от природы газа и определяются экспериментально. Соответствующая формула давления газа примет вид:
P = n * R * T / (V - n * β) - α * n2 / V2.
В реальных газах зависимость давления от объема является более сложной, чем в идеальных.
Похожие статьи
- К чему снятся змеи женщине? Толкование снов
- Многочлены. Разложение многочлена на множители: способы, примеры
- Белоруссия или Беларусь: как правильно говорить и писать?
- Подготовка к исповеди. Список грехов для исповеди
- К чему снится смерть детей? Сонник: умер ребенок. Толкование снов
- Характеристика Льва-женщины. Знак Зодиака Лев: описание
- Закрыть гештальт - что это? Значение и особенности
