H2CO3 название кислоты: свойства, характеристики, воздействие

Угольная кислота H2CO3 широко распространена в природе. Она присутствует во всех газированных напитках, придавая им легкую игристость. А знали ли вы, что эта кислота участвует во многих важных биохимических процессах в нашем организме? Давайте разберемся, что из себя представляет эта загадочная H2CO3.
Строение и свойства угольной кислоты
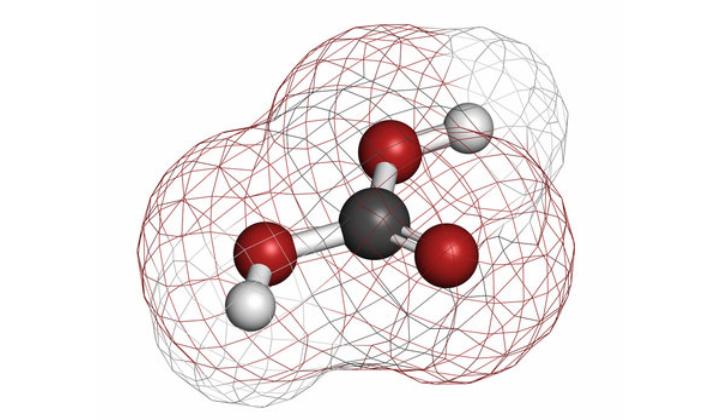
H2CO3 - химическая формула угольной кислоты. В быту ее также называют "углекислотой" или "угольной".
Угольная кислота представляет собой бесцветные кристаллы, которые устойчивы при низких температурах. При температуре -30°С они сублимируются, а при дальнейшем нагревании полностью разлагаются.
Молекула H2CO3 имеет плоское строение. Центральный атом углерода в ней находится в состоянии sp2-гибридизации. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи.
- Длина связи C-O в карбонат-ионе составляет 130 пм.
- Молекулярная масса H2CO3 - 62 г/моль.
H2CO3 является слабой двухосновной кислотой и слабым электролитом. При диссоциации в водных растворах она распадается на ионы:
H2CO3 <=> H+ + HCO3- HCO3- <=> H+ + CO3(2-)Константа кислотности H2CO3 при 25°C составляет:
- K1 = 4,3*10-7 (1-я ступень диссоциации)
- K2 = 4,7*10-11 (2-я ступень диссоциации)
Однако на практике часто используют кажущуюся константу кислотности H2CO3, которая учитывает равновесие между самой кислотой и гидратированной формой CO2:
K = 4,3*10-7
Таким образом, в растворах, содержащих угольную кислоту, образуется сложная система равновесий.
Получение угольной кислоты
В природе угольная кислота H2CO3 образуется при растворении в воде диоксида углерода:
CO2 + H2O <=> H2CO3Это равновесие смещается вправо при понижении температуры и повышении давления CO2.
Другой путь получения H2CO3 - взаимодействие ее солей (карбонатов и гидрокарбонатов) с более сильными кислотами, например серной H2SO4 или азотной HNO 3:
Na2CO3 + H2SO4 = Na2SO4 + H2CO3При этом большая часть образовавшейся угольной кислоты разлагается на воду и CO2.
В лабораториях чистую H2CO3 можно получить особыми методами - реакцией этанола или эфиров с оксидом серы(VI) в присутствии катализаторов. Однако выход продукта при таком синтезе невысокий.
Применение угольной кислоты
Угольная кислота H2CO3 широко используется в пищевой промышленности для производства газированных напитков. Она придает им игристость и легкую кислинку.
Кроме того, соли H2CO3 (карбонаты и гидрокарбонаты) имеют важное техническое значение. Например, кальциевая соль CaCO3 применяется в строительстве, а натриевая соль Na2CO3 (сода) - для изготовления мыла, стекла, бумаги.
В биохимии используют свойство системы H2CO3-CO2 менять давление газа пропорционально изменению pH. Это позволяет в режиме реального времени отслеживать протекание ферментативных реакций, сопровождающихся изменением кислотности раствора.
Кроме того, угольную кислоту иногда рассматривают как карбоновую кислоту, у которой вместо углеводородного радикала находится гидроксильная группа OH. В таком виде H2CO3 способна образовывать разнообразные производные, характерные для карбоновых кислот.
Воздействие на организм человека
Угольная кислота H2CO3 в небольших концентрациях безвредна для человека. Она естественным образом присутствует в организме как промежуточный продукт обмена веществ.
Однако при попадании концентрированного раствора на кожу возможно раздражение и ожоги. При проглатывании большого количества H2CO3 могут наблюдаться такие симптомы как тошнота, рвота, боли в животе.
Меры предосторожности при работе с угольной кислотой
- Использовать средства индивидуальной защиты - халат, перчатки, очки
- Тщательно мыть руки после работы с H2CO3
- Хранить растворы угольной кислоты в хорошо проветриваемом помещении
- Не принимать пищу на рабочем месте
Нейтрализация избытка угольной кислоты в организме
Для нейтрализации H2CO3 при передозировке или попадании концентрированного раствора внутрь следует:
- Выпить несколько стаканов воды для разбавления
- Принять активированный уголь, который свяжет кислоту
- При необходимости обратиться к врачу
Любопытные факты о H2CO3
- Угольная кислота отвечает за "шипучесть" газированной воды и лимонада
- Соли угольной кислоты используются ракообразными и моллюсками для построения известковых панцирей и раковин
- Вулканические газы содержат повышенные концентрации угольной кислоты
Часто задаваемые вопросы
Многие интересуются, почему H2CO3 называют угольной кислотой, если в ее состав не входит никакой углерод. Это историческое название связано с тем, что раньше диоксид углерода CO2 называли "углекислым газом". Поэтому кислота, образующаяся из него при растворении в воде, была названа угольной.
Также часто интересуются, какая эта кислота по силе и свойствам. H2CO3 относится к слабым кислотам, поскольку лишь частично диссоциирует в водных растворах. По химическим свойствам она близка к карбоновым кислотам, например уксусной.
Некоторые ошибочно считают угольную кислоту очень опасным веществом из-за названия. Однако в разбавленном виде она практически безвредна для человека. Лишь концентрированные растворы могут вызвать ожоги и отравление.
Похожие статьи
- Миф о Геракле: краткое содержание. 12 подвигов Геракла
- Где находятся мощи Спиридона Тримифунтского? Феномен нетленных мощей Спиридона Тримифунтского
- Что изучает история? Зачем нужно изучать историю? История мира
- Многочлены. Разложение многочлена на множители: способы, примеры
- Институты ФСБ России, порядок приема
- Значение колец на пальцах у женщин. Как носить кольца
- Какие бывают предложения по цели высказывания и по интонации? Виды предложений по цели высказывания
