Химическое равновесие и создание условий для его смещения
Изучение параметров системы, включающей исходные вещества и продукты реакции, позволяет выяснить, какие факторы смещают химическое равновесие и ведут к желаемым изменениям. На выводах Ле Шателье, Брауна и других ученых о способах проведения обратимых реакций основаны промышленные технологии, позволяющие осуществить ранее казавшиеся невозможными процессы, получить экономическую выгоду.
Разнообразие химических процессов
По особенностям теплового эффекта многие реакции относят к экзо- или эндотермическим. Первые идут с образованием теплоты, например, окисление углерода, гидратация концентрированной серной кислоты. Второй тип изменений связан с поглощением тепловой энергии. Примеры эндотермических реакций: распад карбоната кальция с образованием гашеной извести и углекислого газа, образование водорода и углерода при термическом разложении метана. В уравнениях экзо- и эндотермических процессов необходимо указывать тепловой эффект. Перераспределение электронов между атомами реагирующих веществ происходит в окислительно-восстановительных реакциях. Четыре типа химических процессов выделяют по особенностям реагентов и продуктов:
- соединение А + В = С;
- разложение С = А + В;
- замещение АВ + С = АС + В;
- обмен АВ + СД = АС + ВД.
Для характеристики процессов важна полнота взаимодействия реагирующих соединений. Этот признак лежит в основе деления реакций на обратимые и необратимые.
Обратимость реакций
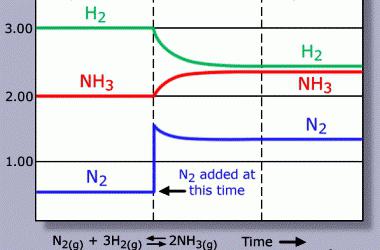
Обратимые процессы составляют большинство среди химических явлений. Образование конечных продуктов из реагентов является прямой реакцией. В обратной же исходные вещества получаются из продуктов своего разложения или синтеза. В реагирующей смеси возникает химическое равновесие, при котором получается столько же соединений, сколько разлагается исходных молекул. В обратимых процессах вместо знака «=» между реагентами и продуктами используются символы «↔» или «⇌». Стрелки могут быть неодинаковыми по длине, что связано с доминированием одной из реакций. В химических уравнениях можно указывать агрегатные характеристики веществ (г — газы, ж — жидкости, т — твердые). Огромное практическое значение имеют научно обоснованные приемы влияния на обратимые процессы. Так, производство аммиака стало рентабельным после создания условий, сдвигающих равновесие в сторону образования целевого продукта: 3Н2(г) + N2(г) ⇌ 2NH3(г). Необратимые явления приводят к появлению нерастворимого или малорастворимого соединения, образованию газа, покидающего сферу реакции. К таким процессам можно отнести ионный обмен, распад веществ.

Химическое равновесие и условия его смещения
На характеристики прямого и обратного процессов влияет несколько факторов. Один из них — время. Концентрация взятого для реакции вещества постепенно снижается, а конечного соединения — возрастает. Реакция прямого направления идет все медленнее, обратный процесс набирает скорость. В определенный промежуток два противоположных процесса идут синхронно. Взаимодействие между веществами происходит, но концентрации не меняются. Причина — динамическое химическое равновесие, установившееся в системе. Его сохранение или изменение зависит от:
- температурных условий;
- концентрации соединений;
- давления (для газов).
Смещение химического равновесия
В 1884 году выдающийся ученый из Франции А. Л. Ле Шателье предложил описание способов вывода системы из состояния динамического равновесия. В основе метода лежит принцип нивелирования действия внешних факторов. Ле Шателье обратил внимание, что в реагирующей смеси возникают процессы, компенсирующие влияние посторонних сил. Сформулированный французским исследователем принцип гласит, что изменение условий в состоянии равновесия благоприятствует протеканию реакции, ослабляющей постороннее воздействие. Смещение равновесия подчиняется этому правилу, оно соблюдается, когда меняется состав, температурные условия и давление. Технологии, основанные на выводах ученых, используются в промышленности. Многие химические процессы, считавшиеся практически неосуществимыми, проводятся благодаря способам смещения равновесия.

Влияние концентрации
Сдвиг равновесия происходит, если изъять из зоны взаимодействия определенные компоненты или дополнительно ввести порции вещества. Удаление продуктов из реакционной смеси обычно вызывает увеличение скорости их образования, добавление веществ, наоборот, приводит к их преимущественному распаду. В процессе этерификации для обезвоживания используют серную кислоту. При введении ее в сферу реакции повышается выход метилацетата: СН3СООН + СН3ОН ↔ СН3СООСН3 + Н2О. Если добавлять кислород, взаимодействующий с диоксидом серы, то химическое равновесие смещается в сторону прямой реакции образования триоксида серы. Кислород связывается в молекулы SO3, его концентрация понижается, что согласуется с правилом Ле Шателье для обратимых процессов.

Изменение температуры
Процессы, идущие с поглощением или выделением тепла, — эндо- и экзотермические. Для смещения равновесия используется нагревание или отвод тепла от реагирующей смеси. Рост температуры сопровождается повышением скорости эндотермических явлений, в которых дополнительная энергия поглощается. Охлаждение приводит к преимуществу экзотермических процессов, идущих с выделением тепла. При взаимодействии диоксида углерода с углем нагревание сопровождается увеличением концентрации монооксида, а охлаждение ведет к преимущественному образованию сажи: СО2(г) + С(т) ↔ 2СО(г).
Влияние давления
Изменение давления — важный фактор для реагирующих смесей, включающих в себя газообразные соединения. Также следует обратить внимание на разницу объемов исходных и получившихся веществ. Понижение давления ведет к преимущественному протеканию явлений, в которых увеличивается общий объем всех компонентов. Рост давления направляет процесс в сторону снижения объема всей системы. Такая закономерность соблюдается в реакции образования аммиака: 0,5N2(г) + 1,5Н2(г) ⇌ NH3(г). Изменение давления не повлияет на химическое равновесие в тех реакциях, которые идут при неизменном объеме.

Оптимальные условия осуществления химического процесса
Создание условий для смещения равновесия во многом определяет развитие современных химических технологий. Практическое использование научной теории способствует получению оптимальных результатов производства. Наиболее яркий пример — получение аммиака: 0,5N2(г) + 1,5Н2(г) ⇌ NH3(г). Повышение содержания в системе молекул N2 и Н2 благоприятно для синтеза сложного вещества из простых. Реакция сопровождается выделением теплоты, поэтому снижение температуры вызовет увеличение концентрации NH3. Объем исходных компонентов больше, чем целевого продукта. Рост давления обеспечит повышение выхода NH3.
В условиях производства подбирают оптимальное соотношение всех параметров (температуры, концентрации, давления). Кроме того, имеет большое значение площадь соприкосновения между реагентами. В твердых гетерогенных системах увеличение поверхности ведет к росту скорости реакции. Катализаторы увеличивают скорость прямой и обратной реакции. Применение веществ с такими свойствами не приводит к смещению химического равновесия, но ускоряет его наступление.
Похожие статьи
- Принцип Ле Шателье в химии
- Что такое обратимая реакция
- Электролитическая диссоциация: уравнение, степень, константа, реакции
- Гидролиз солей. Какие соли подвергаются гидролизу
- Экзотермическая реакция - это процесс, сопровождаемый выделением энергии
- Каталитические реакции: определение, описание, примеры
- Окислительно-восстановительный потенциал: расчет и измерение

