Окислительно-восстановительный потенциал: расчет и измерение
Окислительно-восстановительный потенциал (ОВП) – это параметр, описывающий уровень окисления (оксидации) и восстановления вещества. Другими словами, это способность отдавать или принимать электроны в результате взаимодействия химических элементов в зависимости от природы процессов и условий протекания реакций.

Краткая характеристика
Окислительно-восстановительный потенциал – понятие в большей степени отображающее способность, чем акцию (деятельность). Энергетический потенциал – это энергия, которая скапливается и в любой момент готова к применению. В момент, когда все химические соединения, могущие подвергаться оксидации и редукции, будут использованы, система приходит в состояние равновесия. Чаще всего в таких случаях остается определенный излишек энергии, который образует редукционный или оксидационный потенциал раствора.
Образование ржавчины – типичный пример процесса оксидации/редукции. Элементы, участвующие в этом процессе, подвергаются химическим изменениям. Кислород соединяется с железом, образуя оксид железа (более известный как ржавчина): железо подвергается окислению, а кислород редуцируется. В результате окислительно-восстановительный потенциал системы «Fe/O2» становится равновесным.

ОВП воды
Чистая питьевая вода – очень важный фактор в жизни, о котором зачастую забывают. К сожалению, абсолютно чистых питьевых источников живительной влаги, добываемых в промышленных масштабах для обеспечения населенных пунктов, очень мало. Поэтому воду, поступающую в систему водопроводов, приходится очищать и обеззараживать. Как оказалось, для этого можно использовать свойства ОВП.
Окислительно-восстановительный потенциал воды измеряется в минивольтах (mV). Данный параметр показывает активность дезинфицирующих средств, а не его концентрации, выражаемый в ppm. Химические соединения – хлор, бром, перекись водорода, надуксусная кислота или озон – являются высокоэффективными окислителями (но не всегда безопасными).
Они способны к окислению («отбору») электронов из других химических соединений, поэтому и являются отличными средствами для дезинфекции. Вызывая изменения в химическом состоянии болезнетворных микробов, вредных водорослей и в другом органическом материале, дезсредство убивает их. На практике это означает, что обеззараженная вода с соответствующим уровнем pH может не только уничтожать вредные бактерии, но самоочищаться от них.
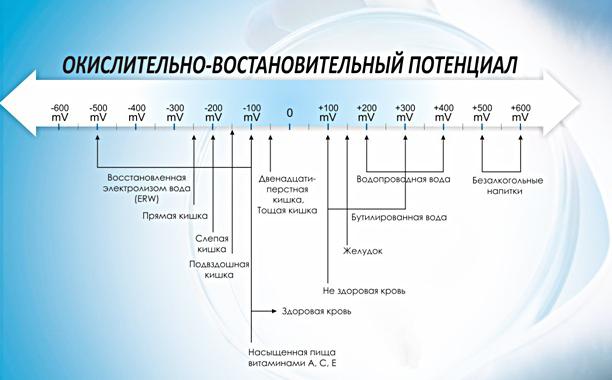
Нормы безопасности
В 1972 году Всемирная организация здравоохранения (WHO) в Регламенте, относящемся к стандартам питьевой воды, установила, что при показателе ОВП, равном 650 mV, вода считается дезинфецированной, а инактивация вирусов наступает почти мгновенно. Исследования показали, что если окислительно-восстановительный потенциал составляет 650 mV, бактерии E. coli уничтожаются мгновенно или в течение нескольких секунд. Для уничтожения более стойких микроорганизмов, таких как листерия, сальмонелла, дрожжи и грибки, необходимо, чтобы показатель ОВП был 750 mV или выше.
Как измерять ОВП
На практике измерение окислительно-восстановительного потенциала осуществляется специальными приборами. Принцип работы устройства, регистрирующего ОВП, основан на измерении напряжения (в минивольтах, mV) в электрической цепи, образованной электродом из серебра (отрицательный полюс) и электродом из платиновой полоски (положительный полюс). Также могут применяться другие материалы, например, графит и стеклоуглерод. Электроды прибора помещаются в водный раствор, а затем снимаются показания.
Измеряется очень малое напряжение (мВ), которое создается при помещении металла в воду, содержащую окисляющие и восстанавливающие вещества. Эти значения напряжения характеризуют потенциал окислителей, содержащихся в жидкости.

Возможные ограничения
Точно измерить стандартный окислительно-восстановительный потенциал не представляется возможным, поэтому на практике значение ОВП исследуемой редокс-пары измеряют относительно любой стандартной полуреакции сравнения и электрода, созданного на ее основе (электрода сравнения). Стандартная полуреакция должна быть обратимой, а электрод сравнения должен обладать постоянным и воспроизводимым потенциалом и иметь достаточно простую конструкцию.
Окислительно-восстановительные электродные потенциалы
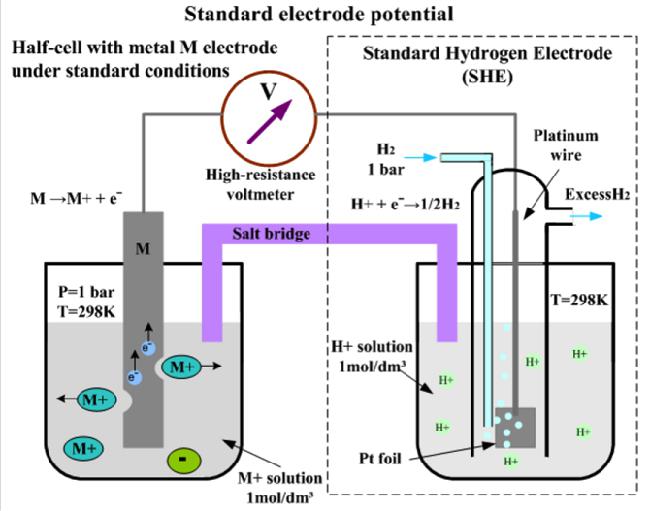
В качестве универсального электрода сравнения для измерения ОВП принят научным сообществом стандартный водородный электрод, состоящий из платиновой полоски, покрытой слоем мелкодисперсной платины (платиновой черни), и погруженной в раствор соляной (серной) кислот с активностью ионов химэлемента водорода, равной единице: аН+=1.
Платина омывается газообразным водородом под давлением 101,3 кПа (или 1 атм), который сорбируется на пористой поверхности платиновой черни. Обозначается стандартный водородный электрод: Pt(H2) (p=1атм) HCl (аН+=1).
На поверхности подобного обратимо работающего электрода протекает полуреакция: 2Н+ + 2е ↔ Н2↑. Потенциал, которой условно принят нулю при любой температуре: ЕСВЭ=0. Следует отметить, что СВЭ не является окислительно-восстановительным электродом, а относится к так называемым электродам первого рода. Их потенциал зависит от активности определенных катионов – в приведенном примере от активности катионов водорода.
Окислительно-восстановительные реакции
ОВР называют реакции с изменением степеней окисления реагирующих веществ. При этом изменение степени окисления происходит с присоединением/отдачей электронов. Процессы присоединения и отдачи электронов рассматривают ученые как полуреакции восстановления и окисления соответственно:
- аОк1 + ne ↔ сВос1 (восстановление);
- bBoc2 – ne ↔ dOk2 (окисление).
В каждой полуреакции элемент с более высокой степенью окисления называют окисленной формой (Ок), а в более низкой степени окисления – восстановленной формой (Вос). Окисленная/восстановленная формы вещества представляют сопряженную окислительно-восстановительную пару, называемую редокс-парой. В окислительно-восстановительной паре окисленная форма (Ок) является акцептором электронов, восстановленная форма (Вос) является своеобразным донором электронов. Полуреакции восстановления/окисления неосуществимы по отдельности – если присутствует донор электронов, значит должен присутствовать и акцептор.
Стандартный ОВП
Если потенциал исследуемой окислительно-восстановительной пары измерен в стандартизированных условиях – температура 25ᵒС (298 K), давление 1 атм (101,3 кПа) и активности окисленной и восстановленной форм равны единице (аок = авос = 1 моль/л), то его называют «стандартный окислительно-восстановительный потенциал» и обозначают: Е0ок/вос.
Таблица потенциалов
Стандартные ОВП множества окислительно-восстановительных пар учеными измерены на практике. Их значения в вольтах отображает таблица окислительно-восстановительных потенциалов:
ОВ-пара (Ок/Вос) | Е0Ок/Вос | ОВ-пара (Ок/Вос) | Е0Ок/Вос |
2H+/H2 | 0,00 | F2/2F- | +2,28 |
S0/H2S | -0,14 | MnO4-/Mn2+ | +1,51 |
Fe2+/Fe0 | -0,47 | Cl2/2Cl- | +1,36 |
Zn2+/Zn0 | -0,76 | Fe3+/Fe2+ | +0,77 |
Al3+/Al0 | -1,61 | I2/2I- | +0,54 |
Mg2+/Mg0 | -2,07 | Sn4+/Sn2+ | +0,15 |
Расшифровка значений
Чем больше окислительно-восстановительный потенциал Е0Ок/Вос, тем окисленная форма является более сильной, соответственно, восстановленная форма обладает более слабой функцией восстановления. И наоборот, чем меньше Е0Ок/Вос, тем сильнее восстановленная форма.
Положительный знак потенциала указывает на самопроизвольное протекание реакции восстановления в паре со СВЭ, отрицательный – на самопроизвольное протекание реакции окисления. Потенциалы сильных окислителей будут всегда положительны, а сильных восстановителей – отрицательны.
Таблица окислительно-восстановительных потенциалов свидетельствует, что наибольшими окислительными свойствами обладает молекулярный фтор, а наибольшими восстановительными – металлический магний. При этом ионы фтора и магния практически не обладают восстановительными и окислительными свойствами соответственно.
Уравнение Нернста
Потенциал системы зависит от соотношений концентраций восстановленной и окисленной форм веществ, участвующих во взаимодействии, окружающей температуры, свойств растворителя, рН раствора и других факторов. Расчет окислительно-восстановительного потенциала, выражаемого зависимостью потенциала от состава раствора, показывает уравнение Нернста:
ЕОк/Вос = Е0Ок/Вос + (RT / nF) × ln (aOk / aBoc), где
- ЕОк/Вос – реальный ОВП полуреакции (редокс-пары).
- Е0Ок/Вос – стандартный ОВП полуреакции (редокс-пары).
- n – число электронов ОВ-реакции.
- R = 8,314 Дж/моль х K (молярная газовая постоянная).
- F = 96500 Кл/моль (число Фарадея).
- Т – абсолютная температура (в K).

Восстановление и окисление
Окислительно-восстановительные реакции определяются степенью окисления и восстановления. Окислением считаются процессы, когда атомы, молекулы или ионы отдают электроны. А восстановлением – когда атомы, молекулы или ионы приобретают электроны.
Соответственно различают вещества окислители, присоединяющие электроны (O2, галогены, HNO3, KMnO4), и восстановители, отдающие электроны другим атомам в ходе окислительно-восстановительного процесса (Н2, металлы, HI). Отдавая электроны другим, восстановители сами окисляются, а окислители, принимая электроны от других участников реакции – восстанавливаются: 2FeCl2 + Cl2 → 2FeCl3.
Степень окисления
Это заряд, которым обладал бы атом в химическом соединении, если бы электроны каждой образованной им химической связи были бы полностью смещены к более электроотрицательному атому. Например:
- FeCl2: Fe+2, 2Cl-1;
- NaH: Na+1, H-1;
- CCl4: C+4, 4Cl-1;
- CH4: C-4, 4H+1.
ОВР могут включать частичный или полный переходы электронов, степени окисления элементов при этом меняются. При этом действуют правила:
- В простом веществе степень окисления атома будет равна нулю (Cl2: 2Cl0).
- Степень окисления атомов из состава молекулы также равна нулю.
- Степень окисления атомов сложного иона будет равна заряду иона.

Определение окислительно-восстановительного потенциала почв
ОВП напрямую влияет на структуру почв. Для его измерения электрод втыкают во влажную землю и на специальном приборе определяют значение в мВ (милливольтах). Одновременно в почвах проявляется много процессов и окислительно-восстановительных реакций превращений активных химических элементов: органики, марганца, железа, серы, азота.
Решающее влияние на состояние почв оказывает кислород в двух формах: растворенный во влаге земли и атмосферный. Они находятся в равновесном состоянии. Также на окислительно-восстановительные процессы влияют редуцирующие вещества микроорганизмов. Главными факторами, определяющими направленность и интенсивность ОВП являются:
- Степень увлажнения почв.
- Активность микрофлоры.
- Аэрация почв.
- Содержание органических веществ.
Высоким уровнем ОВП характеризуются автоморфные почвы:
- Сероземы – 350-450 мВ.
- Черноземы – 400-600 мВ.
- Подзолистые – 550-750 мВ.
При орошении потенциал снижается.
ОВП вина
При производстве вина важной его характеристикой является окислительно-восстановительный (редокс) потенциал. Контролируя редокс-потенциал, можно регулировать или хотя бы понимать смысл процессов, «бушующих» при созревании виноматериалов. Это процессы брожения, реакции восстановления и окисления.
При контакте с кислородом изменяются самоокисляемые системы, в результате повышается потенциал. Соответственно, чем более продолжительный этап проветривания виноматериала, тем выше его редокс-потенциал. Если доступ к воздуху прекратить, потенциал плавно уменьшается, достигая определенных значений, называемых предельным потенциалом. Как правило, аэрированные сорта вин имеют показатели 350-500 мВ, вина, созревавшие без доступа воздуха – 100-150 мВ. Чем больший срок прошел с момента розлива алкогольного напитка в бутылки, тем меньше будет его потенциал. Стоит бутылку открыть, либо взболтать, коэффициент мВ резко возрастет.
ОВП в космическом масштабе
Нормальный окислительно-восстановительный потенциал исторически явился определяющим фактором геологической эволюции Земли и других космических тел. Основным окислителем в геологических системах является кислород. Летучесть кислорода (fO2) – мера окисленности природных систем, независимо от присутствия или отсутствия в них газовой фазы, содержащей свободный кислород. Летучесть кислорода контролирует поведение многих элементов в процессах конденсации протопланетного облака, в ходе аккреции планет и формирования их металлических ядер. Эти знания помогают прогнозировать наличие полезных ископаемых.
Применение ОВП на практике
Измерение ОВП позволяет определить эффективность дезинфекции воды, независимо от вида применяемого оксиданта или смеси дезинфицирующих соединений и других факторов. Результат измерения информирует о том, действительно ли эффективен процесс дезинфекции. Измерение ОВП воды можно проводить в любой точке системы, определяя таким образом чистоту источника воды, труб, а также водопроводной инсталляции.
Показатели окислительно-восстановительного потенциала на каждом конце системы должны быть выше, чем 650 мВ. Если ОВП, измеряемое в конце системы, меньше, чем в ее начале, это говорит о том, что система водоснабжения не была хорошо очищена.
Применение ОВП позволяет найти оптимальное равновесие между pH и содержанием несвязанного хлора. Точность измерительных приборов позволяет снизить уровень хлора до такого, в котором нет риска появления коррозии. К примеру, если ОВП составляет 850 мВ, следует понизить уровень хлора, а в случае, когда значение составляет 600 мВ, уровень pH и несвязанного хлора следует проверить и, соответственно, отрегулировать путем уменьшения pH либо повышения наличия хлора.
Технология ОВП применяется в таких областях, как водоподготовка (до и после употребления), металлообработка, обеззараживание свежих овощей и фруктов, озонирование воды (коммерческие аквариумы, дезинфекция воды), производство вина, производство отбеливателей, убойные цеха на птицеводческих фермах, бумажная промышленность (отбеливание целлюлозной массы), бассейны, СПА. Температура воды не влияет на значение ОВП.
Похожие статьи
- Ионизатор воды "Аквалайф": отзывы врачей и потребителей
- Окислительно-восстановительные реакции (ОВР): примеры
- Redox. Окислительно-восстановительные реакции: описание, примеры
- Химические и физические свойства неметаллов
- Что такое ОВР (химия)? ОВР: примеры и решение
- Анаэробы - это бактерии. Особенности анаэробов, классификация и методы культивирования
- Что такое потенциал? Значение, синонимы и толкование
