Что такое фтор? Свойства химического элемента
Фтор является самым легким членом семейства галогенов, элементов группы 17 (VIIA) периодической таблицы. К данной группе также относятся хлор, бром, йод и астат.
Краткая характеристика
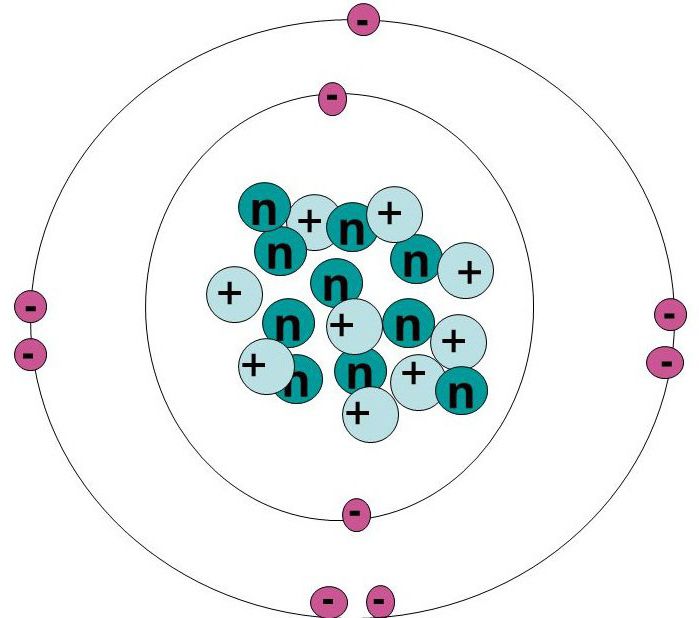
9 электронов фтора образуют конфигурацию 1s22s22p5. В заполненной внутренней оболочке находятся 2 электрона и 7 – на внешней, что оставляет 1 свободное место.
Строение фтора делает его наиболее активным химическим элементом, реагирующим практически со всеми веществами. При высоких температурах и давлениях он даже вступает в реакцию с благородными газами, хотя обычно элементы группы 18 (VIIIA), также известные как инертные газы, не взаимодействуют с другими веществами.
Фтор был открыт в 1886 году французским химиком Анри Муассаном (1852-1907). Он собрал газ, пропуская электрический ток через фтористый водород (H2F2).
О том, что такое фтор, потребители больше всего знают по двум его соединениям. Двухатомный газ используется для получения фторидов, соединений, которые с 1950-х гг. входят в состав зубных паст. Они эффективны в предотвращении кариеса, поэтому их даже добавляют в городские системы водоснабжения.
Другая группа соединений фтора – это хлорфторуглероды (ХФУ). В течение многих лет они были чрезвычайно популярны в качестве аэрозольных пропеллентов. Однако ХФУ в верхних слоях атмосферы реагируют с озоном (О3). Озоновый слой фильтрует вредное ультрафиолетовое излучение Солнца, которое представляет собой электромагнитную радиацию с длинами волн, меньшими длины фиолетового спектра и, следовательно, с более высокой энергией, чем у видимого света. Поэтому производство ХФУ теперь запрещено.

История открытия
Химия всегда была опасной наукой. А ранняя химия являлась смертельно опасным занятием. Ученые работали с веществами, о которых они знали очень мало. Открытие новых соединений и элементов часто имело трагические последствия.
Фтор является чрезвычайно опасным веществом. Пытаясь изолировать элемент, химики получали ужасные ожоги и даже умирали. Газ фтор повреждает мягкие ткани дыхательных путей.
В начале 1500-х годов немецкий ученый Георгий Агрикола (1494-1555) описал плавиковый шпат, который назвал «флюоритом». Это слово происходит от латинского глагола fluere («течь»). Агрикола утверждал, что плавиковый шпат, добавленный к расплавленным металлическим рудам, делал их более жидкими, что облегчало работу с ними. Немецкий ученый не знал, что данный минерал содержит фтор в виде фторида кальция (CaF2).
Флюорит стал предметом интенсивного изучения. В 1670 г. немецкий стеклодув Генрих Шванхард обнаружил, что смесь плавикового шпата и кислоты образует вещество, которое можно использовать для травления стекла, т. е. химической реакции образования матовой поверхности. Этот процесс используется для нанесения на стекло узоров, а также для создания точных научных измерительных приборов.
В 1771 г. шведским химиком Карлом Вильгельмом Шееле (1742-86) было найдено новое вещество для травления. Он подробно описал свойства фтористоводородной кислоты (HF). Работа Шееле способствовала интенсивному изучению этого соединения.
Химики искали способы разложить фтористоводородную кислоту на составляющие. Они предполагали, что должен быть обнаружен элемент, которого они никогда не видели прежде. Однако они не знали, что такое фтор и каким опасным он является. Многие исследователи фтористоводородной кислоты стали инвалидами, вдохнув газообразный HF. Один из них, бельгийский химик Paulin Louyet (1818-1850), умер от воздействия этого вещества.

Наконец, в 1888 г. проблема была решена. Французский химик Анри Муассан получил раствор фтористоводородной (HF) кислоты во фториде калия (KHF2). Затем он охладил его до -23 °C и пропустил через него электрический ток. На одном конце аппарата появился газ. Новый химический элемент получил название fluorine, производное от латинского наименования плавикового шпата. Слово «фтор» в 1810 г. предложил Андре Ампер. Оно имеет греческое происхождение и означает «разрушение».
Физические свойства
Фтор представляет собой бледно-желтый газ с плотностью 1,695 г/л. Это делает его примерно в 1,3 раз плотнее воздуха. Фтор переходит в жидкое состояние при температуре -188,13 °C и в твердое – при -219,61 °C. Вещество обладает сильным специфическим запахом, похожим на запах хлора и озона, ощутимым даже в очень малых количествах – до 20 частей на миллиард. Это свойство очень полезно для тех, кто работает с фтором – газ можно обнаружить и избежать вредного воздействия при его попадании в помещение.
Химические свойства
Энергия связи F2 намного ниже, чем у Cl2 или Br2 и идентична перекиси водорода. Высокая электроотрицательность является причиной диссоциации, высокой реактивности и сильных химических связей фтора с другими атомами. Он легко вступает в связь с любым другим элементом, кроме гелия, неона и аргона. Фтор реагирует с большинством соединений, часто очень активно. Например, при смешивании с водой происходит взрыв. По этим причинам в лаборатории необходимо проявлять особую осторожность.
Нахождение в природе
В свободном состоянии элемент фтор не встречается. Наиболее распространенными фторсодержащими минералами являются плавиковый шпат, фторапатит и криолит. Апатит представляет собой сложный минерал, содержащий прежде всего кальций, фосфор и кислород, как правило, в соединении с фтором. Криолит также известен как гренландский шпат, поскольку остров Гренландия является единственным коммерческим источником этого минерала. В основном он состоит из натрийалюминийфторида Na3ALF6.
Главными мировыми производителями сырья для получения фтора являются Китай, Мексика, Монголия и Южная Африка. Соединенные Штаты когда-то добывали небольшое количество плавикового шпата, но последняя шахта была закрыта в 1995 г., и страна стала импортировать фторсодержащие руды.
В земной коре фтор содержится в изобилии. Его доля оценивается примерно в 0,06%. Это делает его примерно 13-м наиболее распространенным элементом в земной коре, что примерно соответствует содержанию марганца или бария.
Что такое фтор-19?
Химический элемент имеет только один природный изотоп – 19F. Изотопы представляют собой другую форму элемента, отличающуюся по массовому числу, которое соответствует количеству протонов и нейтронов в ядре атома. Количество протонов определяет элемент, но число его нейтронов может быть разным. При этом каждая вариация представляет собой изотоп. У фтора-19 большое гиромагнитное отношение и исключительная чувствительность к магнитным полям. Поскольку это единственный стабильный изотоп, он используется в магнитно-резонансной томографии.
Известны 17 радиоактивных изотопов фтора. Из них наиболее стабильным является 18F. Его ядра делятся с периодом полураспада 109,77 минуты. 18F иногда используется для медицинских исследований. Попадая в организм, фтор перемещается в основном в кости. Его присутствие может быть обнаружено испускаемым им излучением. Радиационная картина позволяет определить состояние костной ткани. Фтор-18 иногда используется аналогично изучению функции мозга.

Получение, определение, использование
Промышленное производство фтора основано на методе Муассана. Электрический ток напряжением 8-12 В пропускают через смесь HF и KF с образованием H2 и F2.
Определение фтора в растворах производится методом потенциометрии, т. е. измерения электродного потенциала. Мембрана электрода изготавливается из монокристаллического LaF3, легированного дифторидами драгоценных металлов.
В элементарном состоянии фтор применяется относительно мало. Он слишком активен для этого. Используется в ракетном топливе, обеспечивая горение, подобно кислороду. Больше всего востребован в связанном состоянии. Фториды представляют собой соединения фтора с металлом. Примерами являются фторид натрия (NaF), кальция (CaF2) и олова (SnF2).
Защита для зубов
Фтор входит в состав зубных паст. Исследования показали, что небольшое количество фторидов может помочь снизить заболеваемость кариесом. Они осаждаются по мере образования нового материала зуба, что делает его сильным и устойчивым к разрушению.
В некоторых городах фториды добавляются в систему водоснабжения. Поступая таким образом, власти надеются улучшить стоматологическое здоровье горожан. Больше всего от этого выигрывает молодежь, чьи зубы все еще развиваются. Процесс добавления фторидов в систему водоснабжения называется фторированием. Слишком большое содержание фтора в воде приводит к потемнению зубов и появлению постоянных пятен.

Польза или вред?
Некоторые беспокоятся о долгосрочном воздействии фторидов в общественном водоснабжении на здоровье населения. Они указывают на то, что фтор является смертельным ядом, и что его соединения также могут быть токсичными. Это правда, F2 очень опасен, но свойства соединений отличаются от составляющих их элементов. Так что беспокойство является беспочвенным.
Сильный характерный запах фтора позволяет обнаружить его утечку и избежать контакта с ним.
Фториды, как правило, опасны только в больших дозах. Их концентрация в воде обычно очень мала, всего несколько частей на миллион. Большинство экспертов в области стоматологии и здравоохранения считают, что такой фтор является полезным и не несет угрозу здоровью людей.
Тефлон
Случайные открытия играют большую роль в научных исследованиях. Примером удачной и очень прибыльной случайности может служить материал тефлон – пластик, изготавливаемый компанией DuPont Chemical Company. Он стал важным коммерческим продуктом, потому что к нему практически почти ничего не прилипает. Сегодня у каждого есть сковороды, внутренняя поверхность которых покрыта этим материалом, поскольку во время готовки пища не пригорает. Кроме того, тефлоновые сковороды не нуждаются в растительном или животном масле.

Тефлон был случайно обнаружен в 1938 г. химиком компании «Дюпон» Роем Планкеттом (1911-1994), который занимался разработкой хлорфторуглеродов (ХФУ). Он хотел узнать, что произойдет, если смешать тетрафторэтилен (ТФЭ) C2F4 с хлорной кислотой. Для проведения эксперимента он установил оборудование таким образом, чтобы газообразный ТФЭ должен был поступать в емкость с HCl. Но когда он открыл вентиль, ничего не произошло. Планкетт мог выбросить сосуд, но он этого не сделал. Вместо этого химик распилил его и обнаружил, что ТФЭ полимеризовался в одну массу, т. е. тысячи отдельных молекул ТФЭ объединились в одну, называемую политетрафторэтиленом (ПТФЭ).
Планкетт выскреб образовавшийся белый порошок и отправил его ученым «Дюпона», занимавшихся разработкой искусственных волокон. Они изучили новый материал и обнаружили его антипригарные свойства. Вскоре для нового материала началась разработка ряда применений.
Компания DuPont зарегистрировала торговую марку Teflon в 1945 г. и через год выпустила свои первые продукты. С тех пор антипригарное покрытие стало обычным на кухонной посуде, тефлон появился в спреях для выпечки и в качестве защиты от пятен для тканей и текстиля.
Хлорфторуглероды
Элемент фтор также использовался в производстве фреонов. Хлорфторуглероды были обнаружены в конце 1920 годов американским инженером-химиком Томасом Мидгли-младшим (1889-1944). Эти соединения обладают рядом интересных свойств. Они очень стабильны и не разрушаются при использовании в промышленности. Фреон широко применялся в системах кондиционирования и в холодильниках, в качестве чистящих средств, в аэрозолях и в составе специализированных полимеров. Производство ХФУ выросло с 1 тыс. т в 1935 г. до более чем 300 тыс. т в 1965 г. и 700 тыс. т в 1985 г.
Однако к середине 1980-х гг. исследования показали, что эти соединения наносят ущерб озоновому слою, который находится на высоте от 20 до 50 км над поверхностью Земли и важен для жизни на нашей планете, потому что защищает ее от вредного ультрафиолетового излучения Солнца. Это привело к постепенному прекращению производства и использования в большинстве стран мира. Появились новые, безопасные для Земли материалы, заменившие ХФУ.

Защита всего живого
ХФУ раньше были популярными промышленными химикатами, потому что их трудно разрушить. Долгое время эти вещества использовались в кондиционерах и холодильниках в качестве агента, переносящего тепло во внешнее пространство. Но ученые поняли, что ХФУ представляют угрозу для озонового слоя, потому что они разрушаются. Как это возможно? Всегда есть вероятность утечки хладагента из кондиционеров и холодильников. ХФУ представляют собой газы или жидкости, которые легко испаряются и поднимаются вверх в атмосферу. В конечном итоге они достигают озонового слоя.
На этой высоте под действием интенсивного солнечного излучения ХФУ разрушаются. Стабильная на земле молекула на большой высоте утрачивает это качество. При ее разрушении выделяется атом хлора, который может вступать в реакцию с O3. Озон фильтрует вредное излучение Солнца, вызывающее сильные солнечные ожоги и рак кожи. Кислород на это не способен. Чем больше ХФУ в атмосфере, тем больше атомов хлора. Чем больше атомов хлора, тем меньше молекул озона и больше ультрафиолета достигает поверхности Земли, оказывая негативное влияние на здоровье человека.
К середине 1980 годов были получены доказательства того, что ХФУ наносят ущерб озоновому слою. Именно это убедило политиков запретить дальнейшее производство и использование хлорфторуглеродов.
Влияние на здоровье человека
Фтор – химический элемент, который может быть очень опасным. При вдыхании в небольших количествах он вызывает сильное раздражение дыхательной системы (носа, горла и легких). В больших количествах это может привести к смерти. Наибольшая допустимая доза фтора составляет 1 часть на миллион частей воздуха в течение 8 часов.
Похожие статьи
- Фторид натрия: формула. Натрия фторид: применение
- Фторопласт - это что такое? Технические характеристики, свойства материала
- Что такое галогены в химии?
- Что такое электроотрицательность: немного теории
- Что такое простое вещество? Свойства простых веществ
- Что такое бром? Химический элемент бром: формула, свойства
- Минеральные вещества: таблица. Значение минеральных веществ
