Что такое бром? Химический элемент бром: формула, свойства

Жидкость красно-бурого цвета, с резким специфическим запахом, плохо растворимая в воде, но растворяющаяся в бензоле, хлороформе, сероуглероде и других органических растворителях. Такой ответ можно дать на вопрос: "Что такое бром?" Соединение относится к группе наиболее активных неметаллов, реагируя со многими простыми веществами. Оно является сильно токсичным: вдыхание его паров раздражает дыхательные пути, а попадание на кожу вызывает тяжелые, длительно не заживающие ожоги. В нашей статье мы изучим его физические свойства, а также рассмотрим химические реакции, характерные для брома.

Что такое бром?
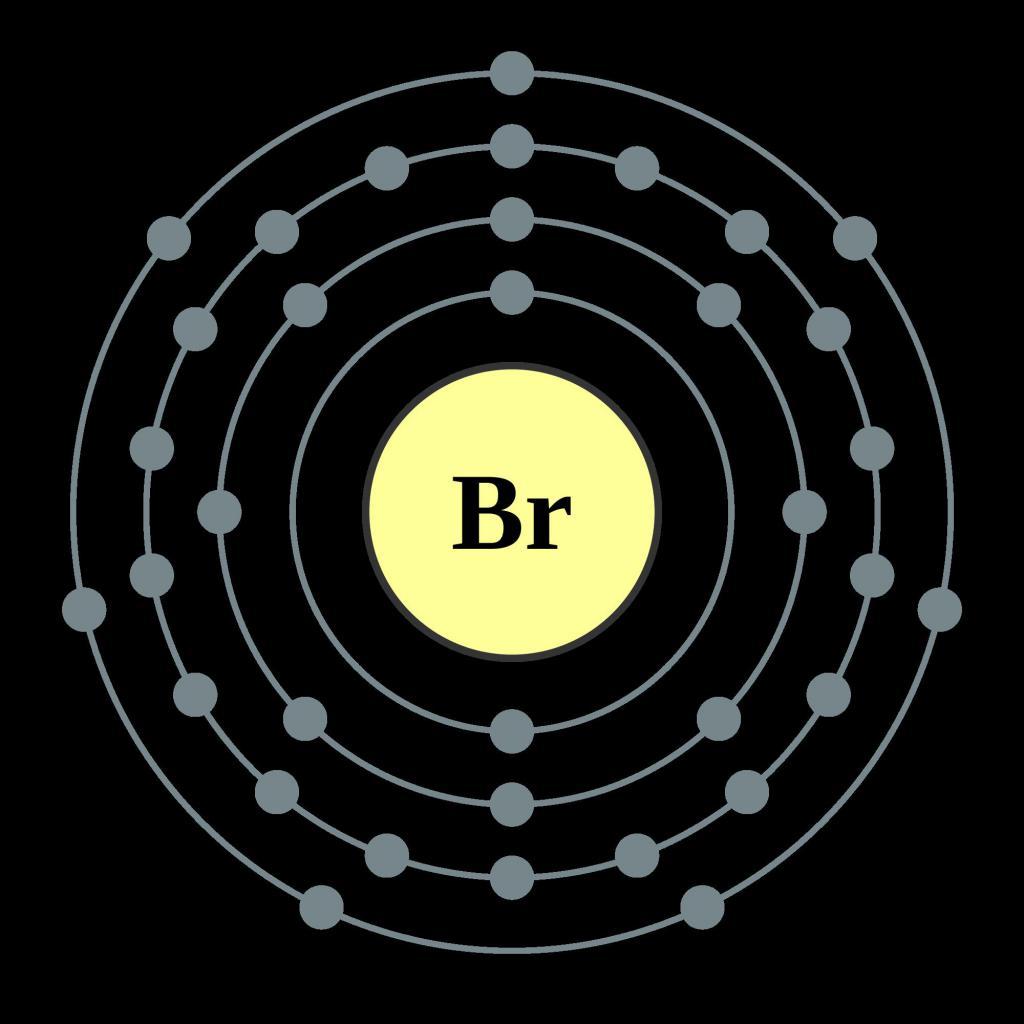
Главная подгруппа седьмой группы – место положения элемента в периодической системе химических элементов. На последнем энергетическом слое атома находится два s-электрона и пять p-электронов. Как и все галогены, бром имеет значительное сродство к электрону. Это значит, что он легко притягивает в свою электронную оболочку отрицательные частицы других химических элементов, становясь анионом. Молекулярная формула брома – Br2. Атомы соединяются между собой с помощью совместной пары электронов, такой тип связи называется ковалентной. Она также является неполярной, располагаясь на одинаковом расстоянии от ядер атомов. Ввиду достаточно большого радиуса атома – 1,14A°, окислительные свойства элемента, его электроотрицательность и неметаллические свойства становятся меньше, чем у фтора и хлора. Температура кипения, наоборот, повышается и составляет 59,2 °C, относительная молекулярная масса брома равна 180. В свободном состоянии из-за высокой активности элемент как простое вещество не встречается. В природе его можно обнаружить в связанном состоянии в виде солей натрия, магния, калия, особенно высоко их содержание в морской воде. Некоторые виды бурых и красных водорослей: саргассум, фукус, батрахоспермум, содержат большое количество брома и йода.

Реакции с простыми веществами
Для элемента характерно взаимодействие со многими неметаллами: серой, фосфором, водородом:
Br2 + H2 = 2HBr
Однако бром непосредственно не реагирует с азотом, углеродом и кислородом. Большинство металлов легко окисляются бромом. Пассивны к действию галогена лишь некоторые из них, например, свинец, серебро и платина. Реакции с бромом более активных галогенов, таких, как фтор и хлор, проходят быстро:
Br2 +3 F2 = 2 BrF3
В последней реакции степень окисления элемента равна +3, он выступает в роли восстановителя. В промышленности бром получают окислением бромоводорода более сильным галогеном, например, хлором. Основными источниками сырья для получения соединения служат подземные буровые воды, а также сильно концентрированный раствор соляных озер. Галоген может взаимодействовать со сложными веществами из класса средних солей. Так, при действии бромной воды, имеющей красно-бурую окраску, на раствор сульфита натрия, мы наблюдаем обесцвечивание раствора. Это происходит по причине окисления бромом средней соли – сульфита до сульфата натрия. Сам же галоген восстанавливается, переходя в вид бромоводорода, не имеющего цвета.

Взаимодействие с органическими соединениями
Молекулы Br2 способны к взаимодействию не только с простыми, но и со сложными веществами. Например, реакция замещения проходит между ароматическим углеводородом бензолом и бромом при нагревании, в присутствии катализатора – бромида трехвалентного железа. Она заканчивается образованием бесцветного соединения, не растворимого в воде – бромбензола:
C6H6 + Br2 = C6H5Br + HBr
Простое вещество бром, растворенное в воде, используется в качестве индикатора для определения наличия в молекуле органических веществ непредельных связей между атомами углерода. Такой качественной реакцией находят в молекулах алкенов или алкинов пи-связи, от которых зависят основные химические реакции указанных углеводородов. Соединение вступает в реакции замещения с предельными углеводородами, при этом образуя производные метана, этана и других алканов. Известна реакция присоединения частиц брома, формула которых Br2, к непредельным веществам с одной или двумя двойными, или с тройной связью в молекулах, например, к таким, как этен, ацетилен или бутадиен.
СН2=СН2 + Br2 = CH2Br - CH2Br
С указанными углеводородами может реагировать не только простое вещество, но и его водородное соединение – HBr.
Особенности взаимодействия галогена с фенолом
Органическое вещество, состоящее из бензольного ядра, связанного с гидроксильной группой, – это фенол. В его молекуле прослеживается взаимное влияние групп атомов друг на друга. Поэтому реакции замещения с галогенами у него протекают значительно быстрее, чем у бензола. Причем для процесса не требуется нагревание и присутствие катализатора. Сразу три атома водорода в молекуле фенола замещаются радикалами брома. В результате реакции образуется трибромфенол.

Кислородные соединения брома
Продолжим изучение вопроса, что такое бром. Взаимодействие галогена с холодной водой приводит к получению бромноватистой кислоты HBrO. Она является более слабой, чем соединение хлора, за счет снижения ее окислительных свойств. Еще одно соединение – бромноватая кислота, может быть получено путем окисления бромной воды хлором. Ранее в химии считали, что у брома не может быть соединений, в которых он мог бы проявлять степень окисления +7. Однако окислением бромноватого калия была получена соль – бромат калия, а из нее – и соответствующая кислота – HBrO4. Ионы галогенов имеют восстановительные свойства: при действии молекул HBr на металлы последние окисляются катионами водорода. Поэтому с кислотой взаимодействуют только те металлические элементы, которые стоят в ряду активности до водорода. В результате реакции образуются средние соли – бромиды, и выделяется свободный водород.
Применение соединений брома
Высокая окислительная способность брома, масса которого достаточно велика, широко используется в аналитической химии, а также в химии органического синтеза. В сельском хозяйстве препараты, содержащие бром, применяют в борьбе с сорняками и насекомыми – вредителями. Антипирены – вещества, предотвращающие самовозгорание, используют для пропитки строительных материалов, пластмассы, ткани. В медицине давно известно тормозящее действие солей: бромида калия и натрия - на прохождение биоэлектрических импульсов по нервным волокнам. Их применяют при лечении расстройств нервной системы: истерии, неврастении, эпилепсии. Учитывая сильную токсичность соединений, дозировка препарата должна контролироваться врачом.
В нашей статье мы выяснили, что такое бром, и какие физические и химические свойства для него характерны.
Похожие статьи
- Бромная вода: ее свойства и особенности
- "Адонис-Бром": инструкция по применению, показания, аналоги, отзывы
- Бром в армии: миф или реальность?
- Ноотропные и седативные препараты в жизни современного человека
- Что такое галогены в химии?
- Бишофит: применение, отзывы. «Бишофит» (гель): инструкция по применению
- Электрофорез - что это такое? Раствор для электрофореза
