Квантово-механическая модель атома и его строение

Планетарная квантово-механическая модель атома Бора часто запоминается за счет аккуратной и знакомой картины электронов. Они вращаются вокруг центрального ядра, подобно планетам вокруг Солнца. Из-за этого может быть сложно заменить картину той, которая более точно представляет квантово-механическую модель атома, используемую современными физиками.
Как располагается и движется атом?
Атом обладает крошечным ядром и волнами острых орбит. Расположение и движение электронов описывается волнами их материи. Эти структуры предсказывают вероятность нахождения электрона в данной области атома. Но откуда появилась квантово механическая модель атома Бора?
Планетарная модель положила начало процессу введения квантовой теории в структуру атома. Бор ввел идею стационарных состояний, в которых атом был устойчив. Переходы между этими состояниями объясняли существование спектральных линий. В случае водорода он смог получить энергетические уровни:
- Переходы между его энергетическими уровнями соответствовали линиям в водородном спектре.
- Его модель не могла предсказать уровни энергии для любых других атомов (хотя уровни водородоподобных щелочных металлов можно было бы приблизить к истине).
Отдельно проводились работы Гейзенберга и Шредингера, чтобы придумать способы более полного описания квантованных энергетических уровней атомов.
Аналогии Гейзенберга и Шредингера: как они привели уравнение к доказательству волны
Квантово-механическая модель строения атома обладает уникальным набором свойств. Гейзенберг использовал матрицы, а Шредингер разработал волновое уравнение, чтобы доказать абсолютность разницы в поведении кванта. Детальнее двоякость частицы показана на видео.

Уравнения Шредингера обеспечивают представление плотности картины вероятности электронов вокруг ядра атома. Большинство определений квантовой теории и квантовой механики предлагают одинаковое описание для обоих. Они по существу описывают квантовую теорию, в которой и энергия, и материя имеют характеристики волн в одних условиях и характеристики частиц — в других.
Чтобы идея была понятней, люди стали проводить эксперименты в условиях мысленного посыла.

- Квантовая теория предполагает, что энергия приходит в дискретных пакетах, называемых квантами (или — в случае электромагнитного излучения — фотонами).
- Квантовая теория имеет некоторое математическое развитие, часто называемое квантовой механикой, которая предлагает объяснения поведения электронов внутри электронных облаков атомов.
Основные положения квантово механической модели строения атома — это двойственность волн электронов в электронном облаке, которая ограничивает нашу способность одновременно измерять энергию и положение электрона.
Скрытые особенности электронов
Чем точнее мы измеряем энергию или положение электрона, тем меньше мы знаем о другом. Мы не можем точно отметить одновременно положение и импульс электрона. Это приводит к невозможности предсказать траекторию для частицы. Следовательно, поведение электрона описывается иначе, чем поведение частиц нормального размера. Необходимо знать:
- Наиболее распространенным способом описания электронов в атомах в соответствии с квантовой механикой является решение уравнения Шредингера для энергетических состояний электронов этом облаке.
- Когда электрон находится в этих состояниях, его энергия четко определена, а положение — нет.
- Положение описывается картой распределения вероятностей, называемой орбитальной.
Траектория, которую мы обычно связываем с макроскопическими объектами, заменяется электронами в облаках электронов, причем в статистических описаниях указывается не путь, а область, в которой он найден. Поскольку именно электрон в облаке электронов атома определяет его химическое поведение, для понимания химии необходимо описание конфигурации электронов в ключе квантово-механической модели атома.
Принцип неопределенности Гейзенберга: область внутри атома
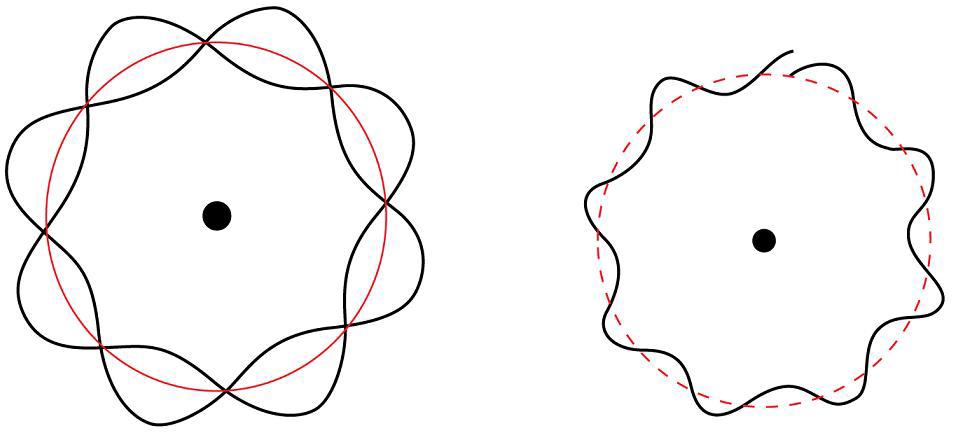
Луи де Бройль предложил, чтобы все частицы можно было рассматривать, как материальные волны с длиной волны — лямбда, определяемая следующим уравнением:
Лямбда = фактическое время (час) + милливольтчас
Эрвин Шредингер предложил квантово-механическую модель атома. Кратко: она рассматривает электроны, как волны вещества.
Квадрат волновой функции представляет вероятность нахождения электрона в данной области внутри атома. Атомная орбита определяется, как область внутри атома, которая находится там, где электрон.
Принцип неопределенности Гейзенберга гласит, что мы не можем знать ни энергию, ни положение электрона. Поэтому, когда мы больше узнаем о положении электрона, мы меньше знаем о его энергии, и наоборот. Электроны имеют внутреннее свойство, называемое спином. Любые два электрона, занимающие одну и ту же орбиту, должны иметь противоположные спины.
Светоносный эфир в квантовом мире
Природа света была предметом исследования с древности. В семнадцатом веке Исаак Ньютон провел эксперименты с линзами и призмами. Он смог продемонстрировать, что белый свет состоит из отдельных цветов радуги, объединенных вместе. Ньютон объяснил результаты своей оптики «корпускулярным» взглядом на свет, в котором свет состоял из потоков чрезвычайно мелких частиц, движущихся на высоких скоростях в соответствии с законами движения Ньютона. Стоит заметить:
-
Кристиан Гюйгенс показал, что оптические явления такие, как отражение и преломление, могут быть одинаково хорошо объяснены с точки зрения света как волны, движущиеся с высокой скоростью через среду, называемую «светоносный эфир». Она пронизывает все пространство.
-
В начале девятнадцатого века Томас Янг продемонстрировал, что свет, проходящий через узкие, близко расположенные щели, создает интерференционные картины, которые не могут быть объяснены с точки зрения ньютоновских частиц, но могут быть легко растолкованы с точки зрения волн.
- Позже, в девятнадцатом веке после того, как Джеймс Клерк Максвелл разработал свою теорию электромагнитного излучения и показал, что свет является видимой частью огромного спектра электромагнитных волн, взгляд частиц на свет стал полностью дискредитирован.
Сегодня эти области называют классической механикой и классической электродинамикой (или классическим электромагнетизмом).
Как прогрессировала идея о внедрении новых понятий в физике

К концу девятнадцатого века ученые рассматривали физическую вселенную как приблизительно состоящую из двух отдельных областей:
- материи, сформированной из частиц, движущихся согласно законам движения Ньютона;
- электромагнитного излучения, состоящего из волн, управляемых уравнениями Максвелла.
Парадоксы привели к современной структуре квантово-механической модели атома Шредингера, которая тесно связывает частицы и волны на фундаментальном уровне, называемом дуальностью волны-частицы, которая заменила классический взгляд.
Дискретная волна Бора: как ведут себя спектры излучения водорода
Согласно модели Бора, спектры излучения различных элементов содержат дискретные линии. Представить видимую область спектров излучения водорода можно при помощи таблицы.
| Основное квантовое число | Количество подуровней | Количество электронов |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 18 |
| 4 | 4 | 32 |
Это схематическое представление квантов, где известно число электронов и уровней. В жизни в условиях вакуума точно нельзя сказать ограничение по подуровням, но их не может быть больше 7. Квантованные спектры излучения указывали Бору, что электроны могут существовать внутри атома только при определенных атомных радиусах и энергиях.

Построив модель, Бор вывел уравнение, которое правильно предсказывало различные уровни энергии в атоме водорода. Квантовая механическая модель подходила только для представления этого конкретного случая. Уровни соответствовали линиям излучения в спектре вещества.
Модель Бора, которая доказала одноэлектронные системы водорода
Скорость электрона на уровне энергии основного состояния водорода составляет 2,2×106 s÷m, где s — длина, m — масса. Мы можем подставить постоянную, а также массу и скорость электрона в уравнение де Бройля. Но при этом он не смог объяснить электронную структуру в атомах, которые содержали более одного электрона.
Если обратиться к химии, квантово-механическая модель атома водорода должна состоять только из протонов. При встрече с электронами или нейтронами частица начинает себя вести, как волна. В остальных случаях атомы другого вещества могут независимо от структуры вести себя подобно волнам или частицам. Если сказать кратко, квантово-механическая модель атома водорода представляет собой материальный дуализм волны, но не частицы.
Наложение волн одну на другую: как не смешиваются пути пересечения атомов
Радиоволны от мобильного телефона, рентгеновские снимки, используемые стоматологами, энергия, используемая для приготовления пищи в вашей микроволновой печи, лучистое тепло от раскаленных предметов и свет от экрана телевизора — все это формы электромагнитного излучения, которые проявляют волнообразное поведение. Необходимо запомнить:
- Волна — это колебание или периодическое движение, которое может переносить энергию из одной точки пространства в другую.
- Встряхивание конца веревки передает энергию от вашей руки к другому концу веревки; падение гальки в пруд приводит к волнам, распространяющимся вдоль поверхности воды; расширение воздуха, сопровождающее удар молнии, генерирует звуковые волны (гром), которые могут путешествовать наружу на несколько миль.
- В каждом из этих случаев кинетическая энергия передается через вещество (веревку, воду или воздух), в то время как вещество остается на месте.
Волны не должны быть ограничены, чтобы путешествовать сквозь материю. Как показал Максвелл, электромагнитные волны состоят из электрического поля, колеблющегося в такт с перпендикулярным магнитным полем. Они перпендикулярны направлению движения. Эти волны могут проходить через вакуум с постоянной скоростью 2,998 × 108 м/с, где с — скорость света.
Похожие статьи
- И. Бунин "Одиночество": анализ стихотворения по плану
- Расположение органов у человека (фото). Внутренние органы человека: схема расположения
- 5 стадий принятия неизбежного. Психология человека
- Где провести выпускной для 4 класса: интересные идеи и рекомендации
- Иван Федоров - биография первопечатника и интересные факты
- Где живет слепая ясновидящая баба Нина: адрес и отзывы
- Подготовительная группа по физкультуре: что нельзя делать?
