Что такое моль в химии
Понятие моль используют для измерения химических веществ. Выясним особенности этой величины, приведем примеры расчетных заданий с ее участием, определим важность данного термина.
Определение
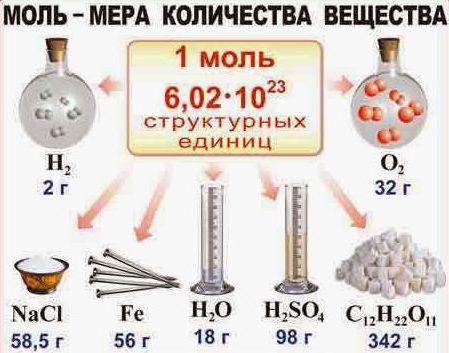
Моль в химии – это единица вычисления. Она представляет собой количество определенного вещества, в котором находится столько структурных единиц (атомов, молекул), сколько содержится в 12 граммах атома углерода.

Число Авогадро
Количество вещества связано с числом Авогадро, которое составляет 6*10^23 1/моль. Для веществ молекулярного строения считают, что один моль включает именно число Авогадро. Если нужно посчитать число молекул, содержащееся в 2 молях воды, то необходимо умножить 6*10^23 на 2 , получаем 12*10^23 штук. Давайте рассмотрим, какую роль играет моль в химии.
Количество вещества
Вещество, которое состоит из атомов, содержит число Авогадро. Например, для атома натрия это 6*10*23 1/моль. Каково его обозначение? Моль в химии обозначают греческой буквой «ню» или латинской «n». Для проведения математических вычислений, связанных с количеством вещества, используют математическую формулу:
n=N/N(A), где n – количество вещества, N(A) – число Авогадро, N – количество структурных частиц вещества.
При необходимости можно вычислить число атомов (молекул):
N=N(A) * n
Фактическая масса моля называется молярной. Если количество вещества определяют в молях, то величина молярной массы имеет единицы измерения г/моль. В численном выражении она соответствует значению относительной молекулярной массы, которую можно определить путем суммирования относительных атомных масс отдельных элементов.

Например, для того чтобы определить молярную массу молекулы углекислого газа, необходимо провести следующие расчеты:
M (CO2)=Ar(C)+2Ar(O)=12+2*16=44
При вычислении молярной массы оксида натрия получаем:
M (Na2O)=2*Ar(Na)+Ar(O)=2*23+16=62
При определении молярной массы серной кислоты суммируем две относительные атомные массы водорода с одной атомной массой серы и четырьмя относительными атомными массами кислорода. Их значения всегда можно найти в периодической таблице Менделеева. В итоге получаем 98.
Моль в химии позволяет проводить разнообразные расчеты, связанные с химическими уравнениями. Все типовые расчетные задачи в неорганической и органической химии, которые предполагают нахождение массы и объема веществ, решаются именно через моли.
Примеры расчетных задач
Молекулярная формула любого вещества указывает на количество молей каждого элемента, включенного в его состав. Например, один моль фосфорной кислоты содержит три моля атомов водорода, один моль атомов фосфора и четыре моля атомов кислорода. Все достаточно просто. Моль в химии является переходом из микромира молекул и атомов в макросистему с килограммами и граммами.
Задача 1. Определите число молекул воды, содержащихся в 16,5 молях.
Для решения используем связь между числом Авогадро (количество вещества). Получаем:
16,5*6,022*1023 = 9,9*1024 молекул.

Задача 2. Рассчитайте число молекул, содержащихся в 5 г углекислого газа.
Сначала необходимо вычислить молярную массу данного вещества, воспользовавшись ее связью с относительной молекулярной массой. Получаем:
M (CO2)=Ar(C)+2Ar(O)=12+2*16=44.
Далее вычисляем число молекул, используя формулу, приведенную выше:
N=5/44*6,023*1023=6,8*1023 молекул.
Алгоритм задач на химическое уравнение
При вычислении массы или продуктов реакции по уравнению используют определенный алгоритм действий. Сначала определяют, какое из исходных веществ в недостатке. Для этого находят их количество в молях. Далее составляют уравнение процесса, обязательно расставляют стереохимические коэффициенты. Над веществами записывают исходные данные, под ними указывают количество вещества, взятое в молях (по коэффициенту). В случае необходимости осуществляют перевод единиц измерения, пользуясь формулами. Далее составляют пропорцию и решают ее математическим способом.
Если предлагается более сложная задача, то предварительно вычисляют массу чистого вещества, убирая примеси, потом уже приступают к определению его количества (в молях). Ни одна задача в химии, связанная с уравнением реакции, не решается без такой величины, как моль. Кроме того с помощью данного термина, легко можно определить количество молекул или атомов, воспользовавшись для таких вычислений постоянным числом Авогадро. Расчетные задания включены в тестовые вопросы по химии для выпускников основной и средней общеобразовательной школы.
Похожие статьи
- Энергия Гиббса и ее использование для описания возможности протекания процессов
- Виды моли и их названия
- Чему равна молярная масса водорода?
- Что такое вещество? Строение и свойства веществ
- Молекулярная масса: базовые принципы определения
- Закон эквивалентов: формула и формулировка. Закон эквивалентов в химии
- Что такое число Авогадро?
