Закон эквивалентов: формула и формулировка. Закон эквивалентов в химии
В конце XVIII века были получены эмпирическим путем многие законы химии. Ими можно было пользоваться и применять их на практике, но точное доказательство было получено лишь много десятилетий спустя. Одним из таких столпов современной химии стал закон эквивалентов, который напрямую связан с другими фундаментальными законами - законом сохранения массы и правилом кратных отношений.
Предыстория
Основанием для нового положения стал уже известный в конце XVIII века закон постоянного состава, позднее названный законом сохранения массы. Благодаря ему было выяснено, что различные химические вещества могут взаимодействовать не произвольно, а в строго определенных пропорциях. Поэтому в химическом лексиконе появились слово «эквивалентность». Новое понятие в переводе на русский язык означало «равноценность». Это был первый шаг к созданию правила, которое позднее стало известно как закон эквивалентов. Многочисленные эксперименты позднее неоднократно подтверждали теоретическую догадку.
Новое правило
Закон эквивалентов в химии несколько раз менял свою формулировку. В современных учебниках он записывается следующим образом:
- «Эквивалентом любого элемента считают такое его количество, которое может соединиться с одним молем водорода».
Такая формулировка закона эквивалентов универсальна и используется в школьной химии и в серьезных научных экспериментах. Например, для известного соединения HCl эквивалент хлора соответствует одному молю, в соединения H2S, H2O эквиваленты для серы и кислорода будут равны ½ моля и так далее. В соединениях вида HnX, где H – водород, X – другой химический элемент, n – количество водорода в молекуле, эквивалент элемента X всегда будет равен 1/n моль. Данный закон эквивалентов в химии распространяется и на простые вещества, в которых водород взаимодействует с одним элементом, и на соединения, в которых водород соседствует со множеством других атомов.
Эквивалентная масса
Выводом из нового закона стало новое понятие массы. Новый термин стал очень удобен для измерения изменения вещества в реакциях. Эквивалентной массой стали называть массу 1 эквивалента. Так, закон эквивалентов предсказывает массу другого элемента даже без лабораторных исследований. На приведенном примере соединения соляной кислоты эквивалентная масса хлора равна 34,45 г/моль. В соединении H2O эквивалентная масса кислорода будет равна 16 : 2 = 8 г/моль и так далее.

Как это можно вычислить
Эквивалентную массу можно высчитать методом анализа полученных соединений. Необязательно при этом исследуемое вещество соединять с водородом для вычисления эквивалентной массы. Закон эквивалентов подтверждает, что достаточно знать состав соединения данного элемента и эквивалентную массу другого элемента, с которым соединяется наш неизвестный образец. Примером нахождения эквивалента может служить следующая задача:
Соединение 3 г натрия с избытком хлора образовало 7,62 г поваренной соли (хлорида натрия). Узнайте эквивалентную массу натрия, если ЭCl = 35,45 г/моль.
Из условия задачи следует, что в продукте реакции – поваренной соли на 3 г натрия приходится 7,62 – 3 = 4,62 г хлора. Отсюда следует вывод:
ЭNa = 3 × 35,45 : 4,62 = 23 г/моль.
Молярная масса натрия легко определяется из таблицы Менделеева. Она равна 23 г/моль. Отсюда следует, что эквивалентная масса натрия равна одному молю.
Сложные элементы
Окружающая нас живая и неживая природа состоит из множества различных веществ, и большинство из них являются сложными. Поэтому часто эквиваленты определяются по-разному, в зависимости от того, из состава какого соседнего вещества они были получены. Но во всех исследуемых случаях различные эквиваленты относились друг к другу как целые малые числа. К примеру, достаточно взять такие известные соединения, как оксид и диоксид серы. Эквивалентные массы этого элемента, вычисленные вышеприведенным способом, дают значения 16 г/моль и 32 г/моль. Но соотношение этих значений сводится к простому виду 1:2.
Данное правило было выведено эмпирическим путем знаменитым английским химиком, врачом и естествоиспытателем Джоном Дальтоном. Учитель-самоучка, ставивший диковинные эксперименты поначалу приводил в испуг слуг и смешил соседей. Тем не менее, ставя свои незатейливые опыты, он подтвердил многие научные предположения. Закон кратных отношений был впервые сформулирован именно им.

Закон эквивалентов распространяется и на сложные соединения, в которых взаимодействуют несколько элементов. Понятие эквивалента для одного из элементов в сложном соединении перестает быть однозначным. Для таких соединений формулировка закона эквивалентов звучит немного иначе: "В качестве эквивалента сложного вещества используется такое его количество, которое будет участвовать в химической реакции без остатка с одним эквивалентом элемента или сложного соединения, либо же с одним эквивалентом водорода".
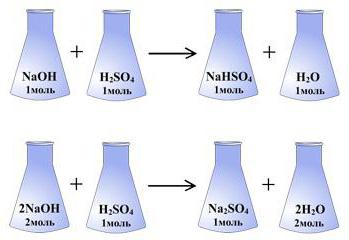
Это правило используется повсеместно. Если убрать громоздкие определения, его можно свести к следующему положению: "Различные вещества могут вступать в реакции только в тех количествах, которые пропорциональны их эквивалентам".
Растворы
При изучении и составлении растворов все вышеперечисленные законы применимы в полной мере. Здесь роль эквивалента играет новая единица, которая носит название г/ эквивалент. Так называется количество вещества, одна частица которого (атом или ион) химически равноценна атому или иону водорода. Таким образом, закон эквивалентов для растворов звучит аналогично классическому определению.

Общий закон эквивалентов
Формула эквивалентов различных соединений в общем случае выглядит так:
- Э = Молярная масса / (число атомов элемента × валентность).
Как можно видеть, эквивалентность находится в прямой зависимости от молярной массы вещества и от его валентности. При наличии у химика информации об эквивалентах неизвестных элементов он может определить его способность вступать в химические реакции. При известном количестве грамм/эквивалентов вещества ученый может сразу сделать вывод о концентрации и свойствах того или иного раствора.

Стехиометрия
Количественному составу веществ и их соотношениям в соединениях посвящен отдельных раздел химии, называемых стехиометрией. Задачи этого раздела теоретической химии состоят в расчете количественных соотношений в соединениях. Для простых веществ это довольно просто, а для сложных – белков или вирусов, стехиометрические расчеты становятся очень трудной задачей.
Похожие статьи
- Основные законы химии. Основные понятия и законы химии
- Защита интеллектуальной собственности в РФ
- Гравиметрический метод анализа: сущность и характеристика
- Джон Дальтон - химик, метеоролог, физик. Джон Дальтон: биография, открытия. Цветовая слепота - дальтонизм
- Функции денег в экономике
- Денежные средства - это... Денежные средства организации. Учет денежных средств
- Молярная концентрация растворов. Что такое массовая концентрация раствора?
