Хлор: валентность, химические свойства
Валентность определяет способность хлора присоединять к себе атомы других химических элементов.
Хлор, валентность которого имеет различные значения, располагается в седьмой группе, в главной подгруппе таблицы элементов. Выясним особенности строения атома этого галогена.
Хлор в нормальном состоянии
Валентность атомов хлора определяется особенностями строения его внешнего уровня. Данный элемент находится в 7(А) группе, имеет семнадцатый порядковый номер. Учитывая, что элемент является представителем четвертого периода, он имеет не только s-, p-, но и d-орбитали.
Электронная конфигурация атома
Какую электронную формулу имеет хлор? Валентность связана с особенностями внешнего энергетического уровня, поэтому запишем конфигурацию данного элемента.
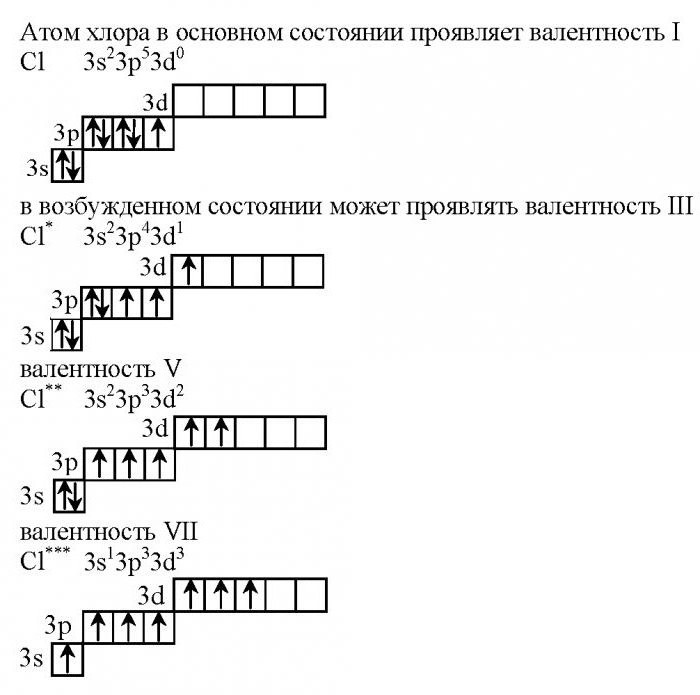
В невозбужденном состоянии на первом уровне у хлора располагаются всего два электрона, второй занимают восемь, на третьем уровне их 10 штук. Отметим, что на последнем уровне есть незаполненная d-орбиталь, которая и характеризует валентные возможности данного галогена.
- 1s22s22p63s23p53d0.
В данном случае валентность хлора равна I. Это характерно при взаимодействии с металлами (образуются хлориды). Высшую валентность VII хлор имеет в соединениях с неметаллами, например, в оксиде хлора (7), а также в хлорной кислоте.
Приведем в качестве примеров формулы соединений хлора, в которых он проявляет такую валентность: HClO4, Cl2O7.
Последний электронный уровень называют в неорганической химии валентным, так как именно он объясняет способность элемента вступать в химические взаимодействия с другими атомами.
Возбужденное состояние
Как ведет себя при нагревании хлор? Валентность его будет меняться в том случае, если атом будет находиться в возбужденном состоянии.
Учитывая тот факт, что у каждого энергетического уровня есть определенный запас энергии, электроны двух первых уровней не изменяют своего первоначального положения. Наблюдается переход одного p-электрона с 3p энергетического уровня на 3d-подуровень. Как будет при этом менять свое участие в химических реакциях хлор? Валентность его изменится, она будет равна трем.
Рассмотрим электронную конфигурацию, которую приобретет в этом случае хлор.
- 1s22s22p63s23p43d1.
Такая конфигурация не является устойчивой, поэтому соединения хлора, в которых он проявляет степень окисления +3, быстро разлагаются.
Так как на 3d-орбитали есть еще четыре свободные квантовые ячейки, возможен последующий переход электрона с 3p-подуровня, который приводит к образованию еще одной конфигурации атома хлора.
- 1s22s22p63s23p33d2.
В этом случае существует пять неспаренных электронов, поэтому хлор способен проявлять валентность V, степень окисления +5.
При максимальном разогревании атома хлора происходит переход электрона с 3s-подуровня на 3d-орбиталь. В этом случае хлор имеет максимальную валентность, равную семи.
- 1s22s22p63s13p33d3.
На внешнем энергетическом уровне у него располагается семь неспаренных электронов, поэтому валентность хлора в соединениях равна 7.
Распределение электронов по уровням, подуровням, их переход осуществляются в соответствии с правилом Хунда и принципом Паули.
Как в этом случае обозначается хлор? Валентность элемента принято указывать римскими цифрами, а возбужденное состояние атома отмечают звездочкой.
Заключение
Все затраты внутренней энергии, которые идут на процесс возбуждения атома хлора, полностью компенсируются той энергией, которая выделяется при образовании ковалентных связей. Это объясняет повышенную химическую активность хлора, находящегося в возбужденном состоянии. В своей максимальной степени окисления (+7) он проявляет свойства сильного окислителя.
Валентные возможности атома химического элемента не ограничиваются только количеством неспаренных электронов в стационарном и возбужденном виде. Например, при образовании связей в молекулах посредством донорно-акцепторного механизма, предполагают использование и свободных орбиталей.
Какие факторы влияют на валентные возможности атома хлора? Подводя итог, скажем, что в первую очередь необходимо отметить количество неспаренных электронов (незаполненные орбитали). Кроме того, в атоме должна быть свободная орбиталь, на которую будут при нагревании переходить электроны.
Похожие статьи
- Хлор: характеристика химических и физических свойств
- Фтор: валентность, химические свойства, характеристики
- Оксид меди (I, II, III): свойства, получение, применение
- Как определить степень окисления атома химического элемента
- Оксид калия: формула, взаимодействие
- Сернистый газ — физические свойства, получение и применение
- Оксид свинца: формула, свойства, метод получения