Фтор: валентность, химические свойства, характеристики
Где располагается в таблице Менделеева фтор? Валентность данного элемента равна одному, следовательно, он является типичным представителем седьмой группы главной подгруппы. Дадим краткую характеристику этому неметаллу, выявим его основные физические и химические свойства.
Страницы истории
Рассмотрим строение атома фтора, но сначала остановимся на истории его открытия. В начале шестнадцатого века немецкий врач и минералог Григорий Агрикола описал минерал, в составе которого содержался фтор. Валентность элемента тогда еще не была известна, поэтому сложно было предсказать его основные свойства.
В конце восемнадцатого века шведскому химику Карлу Шееле удалось синтезировать при нагревании в стеклянном сосуде концентрированной серной кислоты и плавикового шпата фтороводородное соединение. Полученное ученым вещество не вступало во взаимодействие с металлами, поэтому Шееле сделал вывод о незначительной химической активности плавиковой кислоты.
В безводном виде она была получена только в начале девятнадцатого века, но никому не удавалось выделить из соединения чистый фтор. Валентность данного неметалла долгое время оставалась для химиков настоящей загадкой.
Только в 1886 году Муассану удалось путем электролиза водного раствора гидрофторида кальция выделить чистый фтор. Валентность неметалла он так и не определил, но за свое исследование был удостоен Нобелевской премии в области химии (1906 год).
Из-за токсических свойств, выявленных у данного химического элемента, его изучение было достаточно продолжительным. Только после Второй мировой войны фтор стали получать путем промышленной переработки фторидов.
Нахождение в природе
Молекула фтора не встречается в природе в чистом виде. Среди самых распространенных соединений фтора отметим плавиковый шпат. Именно флюорит на протяжении нескольких столетий применяли в качестве очищающего компонента в металлургическом производстве. Исследователям удалось определить, что минерал, используемый для выделения фтора, обладает свойством флуоресценции, то есть способностью давать синеватый цвет при дополнительном освещении.
Формула фтора была определена значительно позже, причиной стала его незначительная распространенность в земной коре (не больше 0,065 процента). В качестве основных соединений можно рассмотреть топаз, криолит, а также лепидолит.

Особенности свойств
Данный неметалл при обычных условиях является бледно-желтым газом, имеющим раздражающий запах. Вдыхание фтора опасно для человека, поэтому так долго не было достоверной информации о физических характеристиках этого галогена. В ходе исследований был выявлен один стабильный изотоп этого элемента, имеющий вид – фтор-19. Специфическое строение атома фтора объясняет его способность размещать вокруг атома устойчивые комплексы. Например, выявлены гексафторсиликаты и гексафтоалюминаты, причем фтор проявляет свои сильные окислительные свойства.
Ни у какого другого неметалла, располагающегося в таблице Менделеева, нет такой способности к образованию анионов. Именно по этой причине фтор не встречается в природе в чистом виде. Только в конце двадцатого века американскому химику Карлу Крайсту удалось осуществить получение фтора. Для этого он провел электролиз раствора пентафторида сурьмы.
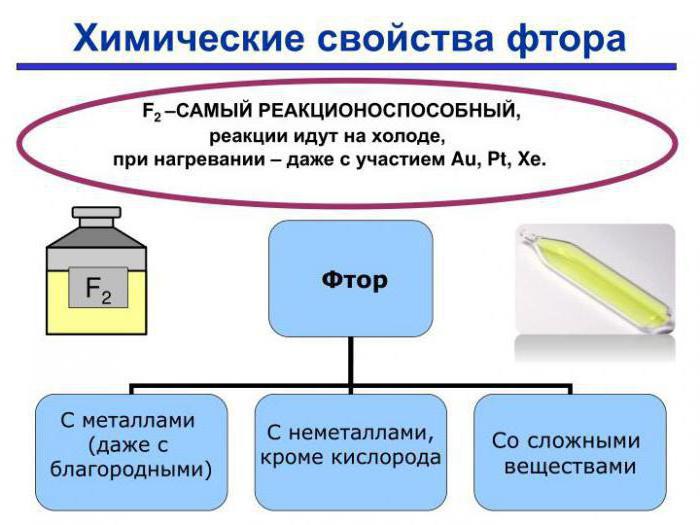
Химические свойства фтора основываются на его способности к присоединению электрона от других элементов. Имея на внешнем уровне семь валентных электронов, он проявляет степень окисления -1.
Основные химические свойства фтора можно объяснить особенностями строения его атома. У данного элемента нет свободной d-орбитали, как у хлора, поэтому для него не характерны положительные значения степеней окисления.
Благодаря высокой окислительной способности данного элемента, он образует соединения, нехарактерные для иных галогенидов: трифторид кобальта, дифторид серебра, гептафторид рения, гептафторид йода.

Типичные соединения
Основная масса фтора находится в виде различных соединений, имеющих практическое значение. Например, фторуглеродные масла считают оптимальными смазочными материалами. Фтор легко вступает во взаимодействие с деревом, резиной, тканями, что нашло применение во фторировании органических веществ. При этом важно соблюдать предосторожность, чтобы не ощутить на себе токсического действия данного элемента.
Производство
Получение фтора основывается на переработке плавикового шпата. Изготовление фтороводорода сопровождается перегонкой порошкообразного флюорита с концентрированной серной кислотой. Данный процесс осуществляется в чугунном или свинцовом аппарате. После перегонки образуется сульфат кальция, не способный растворяться во фтороводороде. Для получения HF используют фракционную перегонку в стальных или медных сосудах. Фтороводород хранят в стальных емкостях.
В качестве основных примесей, содержащихся в данном соединении, отметим серную, сернистую и кремнефтористоводородную кислоту. Они образуются из-за наличия кремнезема в плавиковом шпате. Для удаления из реакционной смеси следов влаги, проводят электролиз на платиновых электродах. Готовая формула фтора хранится над сильной кислотой Льюиса, способной образовывать соли.

Востребованность HF
Фтористый водород востребован в производстве разных органических и неорганических соединений фтора. К примеру, с его помощью образуется Na3AlF6, применяемый в качестве электролита в процессе выплавки алюминия. Плавиковая кислота, являющаяся раствором HF, в больших количествах нужна для очистки металлов и полировки. Она придает стеклу матовый цвет, необходима для травления.
Чистый фтор можно размещать в стальных баллонах под давлением только в том случае, если на клапанах нет органических веществ.

Фториды
Рассматриваемый химический элемент применяют при производстве разных фторидов, например, трифторида кобальта, гексафторида серы. Именно эти соединения являются востребованными фторирующими агентами органических веществ. Гексафторид серы нашел применение в качестве газообразного диэлектрика.
Элементарный фтор в смеси с азотом способен реагировать с углеводородами. В качестве продукта реакции образуется определенный фтороуглерод, где водород в полной мере или частично замещен галогеном. Образующиеся соединения отличаются высокой стабильностью, отличным электрическим сопротивлением, а также химической инертностью.

Особенности фторирования
Осуществить это процесс можно с помощью обработки органического соединения трифторидом кобальта, а также путем электролиза его водного раствора. Тефлон, хорошо знакомый российским хозяйкам, известен в химии в качестве политетрафторэтилена, получаемого при галогенировании непредельных углеводородов.
В кондиционерах и холодильниках используют специальный хладагент (дихлордифтометан). В связи с тем, что подобные реагенты оказывали негативное воздействие на атмосферу, способствовали истощению озонового слоя, постепенно их производство было ограничено. В настоящее время их заменили хладагенты, которые в своем составе имеют гидрофторуглероды.

Заключение
Фтор проявляет самые сильные окислительные свойства из всех представителей подгруппы галогенов. Он имеет небольшой радиус атома, а значит, ему гораздо проще принимать один электрон, поэтому фтор используют для получения фторидов.
Например, гексафторид урана применяют при газовом диффузионном процессе выделения урана-235 из 238, что характерно для производства ядерного топлива. Трифторид бора и фтороводород производят в больших объемах, поскольку эти компоненты являются отличными катализаторами для алкилирования, они востребованы в производстве органических соединений. Например, при добавлении в питьевую воду фторида натрия, можно снизить заболеваемость кариесом.
В настоящее время особое значение получило применение фтора в сельскохозяйственной и фармацевтической промышленности. Например, при количественном осаждении фторида кальция, его последующей обработке уксусной кислотой можно вычислить содержание данного элемента и использовать полученные результаты для количественного анализа.
Благодаря современным методам качественного и количественного анализа, широко применяемым в аналитической химии, стало возможным использование разнообразных соединений фтора. Именно этот представитель подгруппы галогенов является одним из самых востребованных элементов в органической и в неорганической химии.
Похожие статьи
- Химические и физические свойства неметаллов
- Как определить степень окисления атома химического элемента
- Хлор: характеристика химических и физических свойств
- Хлор: валентность, химические свойства
- Как составить электронную формулу химического элемента в неорганической химии
- Что такое углерод? Описание, свойства и формула углерода
- Что такое фтор? Свойства химического элемента
