Как определить степень окисления атома химического элемента
Формальный заряд атома в соединениях — вспомогательная величина, обычно ее используют в описаниях свойств элементов в химии. Этот условный электрический заряд и есть степень окисления. Его значение изменяется в результате многих химических процессов. Хотя заряд является формальным, он ярко характеризует свойства и поведение атомов в окислительно-восстановительных реакциях (ОВР).
Окисление и восстановление
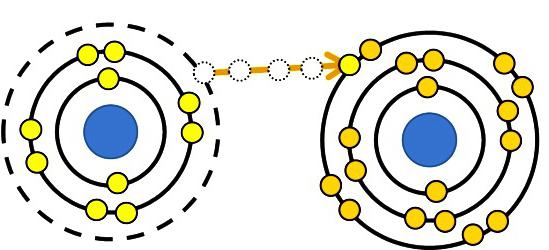
В прошлом химики использовали термин «окисление», чтобы описать взаимодействие кислорода с другими элементами. Название реакций произошло от латинского наименования кислорода - Oxygenium. Позже выяснилось, что другие элементы тоже окисляют. В этом случае они восстанавливаются — присоединяют электроны. Каждый атом при образовании молекулы изменяет строение своей валентной электронной оболочки. В этом случае появляется формальный заряд, величина которого зависит от количества условно отданных или принятых электронов. Для характеристики этой величины ранее применяли английский химический термин "oxidation number", который в переводе означает «окислительное число». При его использовании исходят из допущения, что связывающие электроны в молекулах или ионах принадлежат атому, обладающему более высоким значением электроотрицательности (ЭО). Способность удерживать свои электроны и притягивать их от других атомов хорошо выражена у сильных неметаллов (галогенов, кислорода). Противоположными свойствами обладают сильные металлы (натрий, калий, литий, кальций, другие щелочные и щелочноземельные элементы).
Определение степени окисления
Степенью окисления называют заряд, который атом приобрел бы в том случае, если бы принимающие участие в образовании связи электроны полностью сместились к более электроотрицательному элементу. Есть вещества, не имеющие молекулярного строения (галогениды щелочных металлов и другие соединения). В этих случаях степень окисления совпадает с зарядом иона. Условный или реальный заряд показывает, какой процесс произошел до того, как атомы приобрели свое нынешнее состояние. Положительное значение степени окисления — это общее количество электронов, которые были удалены из атомов. Отрицательное значение степени окисления равно числу приобретенных электронов. По изменению состояния окисления химического элемента судят о том, что происходит с его атомами в ходе реакции (и наоборот). По цвету вещества определяют, какие произошли перемены в состоянии окисления. Соединения хрома, железа и ряда других элементов, в которых они проявляют разную валентность, окрашены неодинаково.
Отрицательное, нулевое и положительное значения степени окисления

Простые вещества образованы химическими элементами с одинаковым значением ЭО. В этом случае связывающие электроны принадлежат всем структурным частицам в равной степени. Следовательно, в простых веществах элементам несвойственно состояние окисления (Н02, О02, С0). Когда атомы принимают электроны или общее облако смещается в их сторону, заряды принято писать со знаком "минус". Например, F–1,О–2, С–4. Отдавая электроны, атомы приобретают реальный или формальный положительный заряд. В оксиде OF2 атом кислорода отдает по одному электрону двум атомам фтора и находится в состоянии окисления О+2. Считают, что в молекуле или многоатомном ионе более электроотрицательные атомы получают все связывающие электроны.
Сера — элемент, проявляющий разные валентность и степени окисления
Химические элементы главных подгрупп зачастую проявляют низшую валентность равную VIII. Например, валентность серы в сероводороде и сульфидах металлов — II. Для элемента характерны промежуточные и высшая валентность в возбужденном состоянии, когда атом отдает один, два, четыре или все шесть электронов и проявляет соответственно валентности I, II, IV, VI. Такие же значения, только со знаком "минус" или "плюс", имеют степени окисления серы:
- в сульфиде фтора отдает один электрон: –1;
- в сероводороде низшее значение: –2;
- в диоксиде промежуточное состояние: +4;
- в триоксиде, серной кислоте и сульфатах: +6.
В своем высшем состоянии окисления сера только принимает электроны, в низшей степени — проявляет сильные восстановительные свойства. Атомы S+4 могут проявлять в соединениях функции восстановителей или окислителей в зависимости от условий.
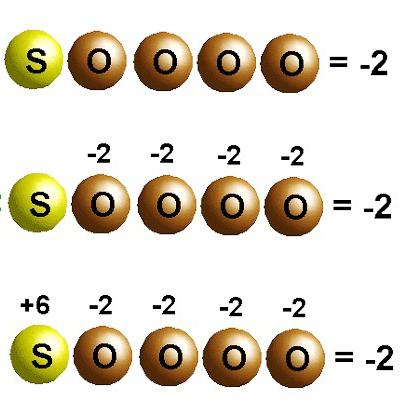
Переход электронов в химических реакциях
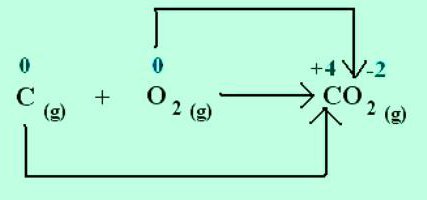
При образовании кристалла поваренной соли натрий отдает электроны более электроотрицательному хлору. Степени окисления элементов совпадают с зарядами ионов: Na+1Cl–1. Для молекул, созданных путем обобществления и смещения электронных пар к более электроотрицательному атому, применимы только представления о формальном заряде. Но можно предположить, что все соединения состоят из ионов. Тогда атомы, притягивая электроны, приобретают условный отрицательный заряд, а отдавая, — положительный. В реакциях указывают, какое число электронов смещается. Например, в молекуле диоксида углерода С+4О-22 указанный в верхнем правом углу индекс при химическом символе углерода отображает количество электронов, удаленных из атома. Для кислорода в этом веществе характерно состояние окисления –2. Соответствующий индекс при химическом знаке О — количество добавленных электронов в атоме.
Как подсчитать степени окисления
Подсчет количества отданных и присоединенных атомами электронов может отнять много времени. Облегчают эту задачу следующие правила:
- В простых веществах степени окисления равны нулю.
- Сумма окисления всех атомов или ионов в нейтральном веществе равна нулю.
- В сложном ионе сумма степеней окисления всех элементов должна соответствовать заряду всей частицы.
- Более электроотрицательный атом приобретает отрицательное состояние окисления, которое записывают со знаком "минус".
- Менее электроотрицательные элементы получают положительные степени окисления, их записывают со знаком "плюс".
- Кислород в основном проявляет степень окисления, равную –2.
- Для водорода характерное значение: +1, в гидридах металлов встречается: Н–1.
- Фтор — наиболее электроотрицательный из всех элементов, его состояние окисления всегда равно –4.
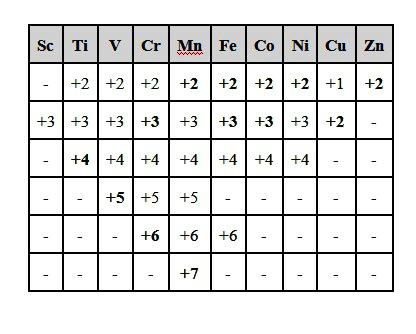
- Для большинства металлов окислительные числа и валентности совпадают.
Степень окисления и валентность
Большинство соединений образуются в результате окислительно-восстановительных процессов. Переход или смещение электронов от одних элементов к другим приводит к изменению их состояния окисления и валентности. Зачастую эти величины совпадают. В качестве синонима к термину «степень окисления» можно использовать словосочетание «электрохимическая валентность». Но есть исключения, например, в ионе аммония азот четырехвалентен. Одновременно атом этого элемента находится в состоянии окисления –3. В органических веществах углерод всегда четырехвалентен, но состояния окисления атома С в метане СН4, муравьином спирте СН3ОН и кислоте НСООН имеют другие значения: –4, –2 и +2.
Окислительно-восстановительные реакции

К окислительно-восстановительным относятся многие важнейшие процессы в промышленности, технике, живой и неживой природе: горение, коррозия, брожение, внутриклеточное дыхание, фотосинтез и другие явления.
При составлении уравнений ОВР подбирают коэффициенты, используя метод электронного баланса, в котором оперируют следующими категориями:
- степени окисления;
- восстановитель отдает электроны и окисляется;
- окислитель принимает электроны и восстанавливается;
- число отданных электронов должно быть равно числу присоединенных.
Приобретение электронов атомом приводит к понижению его степени окисления (восстановлению). Утрата атомом одного или нескольких электронов сопровождается повышением окислительного числа элемента в результате реакций. Для ОВР, протекающих между ионами сильных электролитов в водных растворах, чаще используют не электронный баланс, а метод полуреакций.
Похожие статьи
- Как определить степень окисления: таблица Менделеева и алгоритм действий
- Степени окисления азота в аммонии
- Фосфор и его соединения: степени окисления, формулы
- Окислительно-восстановительный потенциал: расчет и измерение
- Оксид азота: формула, свойства, применение
- Окислительно-восстановительные реакции (ОВР): примеры
- Что такое ОВР (химия)? ОВР: примеры и решение
