Метод валентных связей и его основные положения
Метод валентных связей считается одним из основополагающих принципов неорганической химии. Выявим его особенности, варианты применения.
Теоретические положения
Химической связью считают связь между атомами, сопровождаемую выделением тепловой энергии.
Давайте рассмотрим основные положения метода валентных связей.
Ковалентный вид создается с помощью двух электронов, имеющих противоположные по направлению спины.
Сформированная электронная пара является общей, она формируется в результате спаривания свободных электронов, которые принадлежат двум различным атомам, при этом образуется ковалентная связь.
Метод валентных связей объясняет также механизм связи, при котором у одного атома есть свободная электронная пара. Второй элемент имеет свободную атомную орбиталь, и он является акцептором.
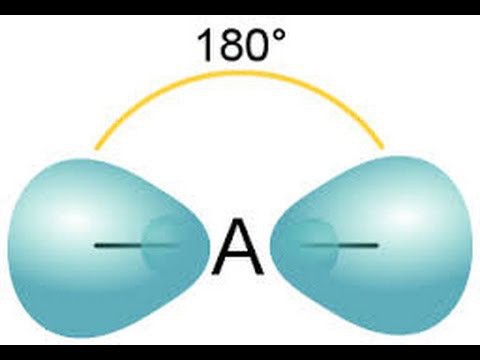
Характеристика ковалентной связи
Какой прочностью обладает химическая связь? Метод валентных связей объясняет зависимость между прочностью ковалентной связи и степенью перекрывания взаимодействующих друг с другом электронных облаков. Образование данного вида связи происходит в том направлении, где наблюдается полное взаимодействие электронных облаков.
Метод валентных связей использует гибридизацию орбиталей основного химического элемента. Формирование связей зачастую происходит после изменения состояния валентных орбиталей.
Особенности образования
Неравноценные исходные атомные орбитали «смешиваются», образуя гибридные орбитали, которые имеют одинаковый запас энергии. Процесс гибридизации сопровождается вытягиванием облака по направлению к взаимодействующему электронному атому, что приводит к перекрыванию гибридного облака с обычным электроном соседнего атома.
Метод валентных связей характеризуется образованием прочной связи. Процесс сопровождается выделением энергии, компенсируемой затратами на процесс гибридизации.
Основные положения метода валентных связей, представленные выше в статье, в полной мере объясняют строение молекул, имеющих ковалентную связь. Она направлена в сторону наибольшего перекрывания орбиталей.
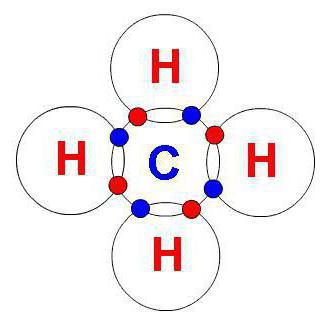
Валентные возможности
Метод валентных связей позволяет понимать, какими валентностями может обладать конкретный химический элемент. В невозбужденном состоянии валентные возможности ограничиваются числом неспаренных электронов, располагающихся на последнем энергетическом уровне. При нагревании наблюдается переход атома из нормального состояния в возбужденный вид. Процесс сопровождается увеличением числа неспаренных электронов.
Энергией возбуждения в химии называют ту величину, что необходима для полноценного перехода атома, обладающего низким запасом энергии, на более высокий вид. Под кратностью связи понимают количество электронных пар, которые обобществлены ближайшими атомами в результате образования ковалентной химической связи.
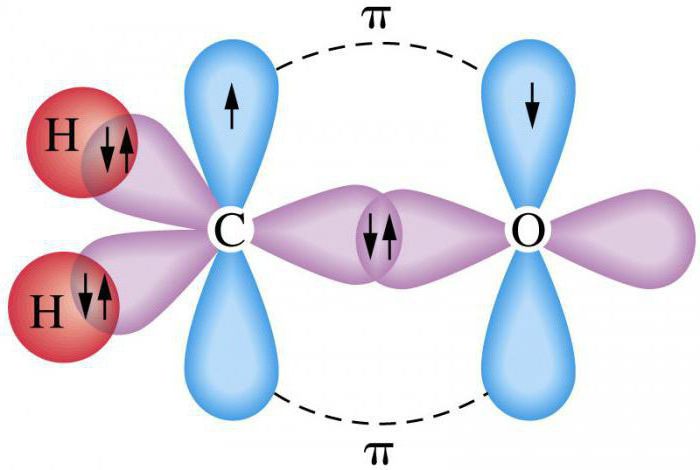
Ϭ и π связи являются приближенным описанием различных видов ковалентных связей в молекулах. Простая (Ϭ связь) образуется между гибридными облаками. Она характеризуется максимальным распределением плотности электронного облака вдоль оси, по которой соединены ядра атомов.
Сложная (π связь) предполагает боковое перекрывание негибридных электронных облаков. При ее формировании плотность электронного облака имеет максимальную величину по всем направлениям.
Характеристика процесса
Гибридизацией связи называют процесс смещения орбиталей различного вида в многоатомной молекуле, образование в итоге облаков, которые имеют одинаковые термодинамические характеристики.
Какое применение имеет метод валентных связей? Примеры органических и неорганических веществ свидетельствуют о его значимости для объяснения строения, а также характерных химических свойств соединений.
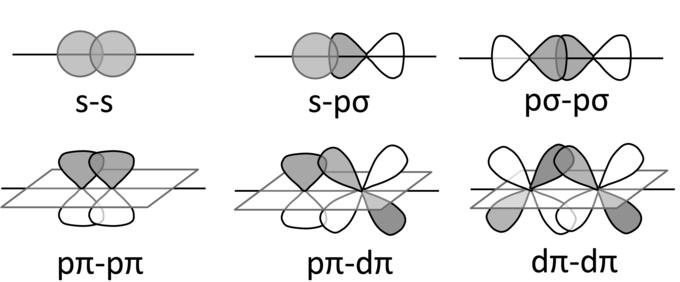
Виды гибридизации
В зависимости от того, какое количество неспаренных электронов смешивается между собой, выделяют несколько основных видов гибридизации.
Вариант sp-типа предполагает смешивание между собой одной s- и р-орбиталей. В результате процесса образуется две одинаковые гибридные орбитали, которые перекрываются между собой под углом 180 градусов. Таким образом, они направлены от ядра атома в разные стороны.
Sp2-гибридизация наблюдается при смешивании двух p-орбиталей с одной s. В итоге формируются три одинаковые гибридные орбитали, которые направлены к вершинам треугольника под одинаковым углом (его величина - 120 градусов).
При sp3-гибридизации смешиваются 3p- и одна s-орбитали. В результате процесса образуется четыре одинаковых гибридных облака, которые образуют тетраэдр. Валентный угол в данном случае составляет 109 градусов 28 минут.
Важные аспекты метода
Выделим несколько важных моментов, характеризующих метод валентных связей. Для образования ковалентной химической связи необходимы два электрона, имеющие противоположные по направлению спины. Например, если рассматривать вариант образования молекулы водорода, то он связан с перекрыванием отдельных электронных орбиталей у двух атомов, появлением между ними одной общей электронной пары.
При анализе ковалентной связи, образованной по донорно-акцепторному типу, приведем в качестве примера образование катиона аммония. Донором в данном случае выступает азот, который имеет собственную электронную пару, а акцептором служит протон водорода, содержащийся в кислотах. В образующемся катионе аммония три связи образованы за счет гибридных облаков, а одна формируется при перекрывании по донорно-акцепторному типу. Электронная плотность распределяется равномерно, поэтому все связи считаются ковалентными.
Заключение
В процессе образования связи между атомами неметаллов наблюдается перекрывание волновых функций электронов. Прочность связи при этом зависит от полноты взаимодействия электронных облаков. В нормальном состоянии валентность атома характеризуется количеством неспаренных электронов, принимающих участие в образовании общих электронных пар с иными атомами.
Для атома, находящегося в разогретом (возбужденном) состоянии, она связана с количеством свободных (неспаренных) электронов, а также с числом не занятых орбиталей.
Подводя общий итог, отметим, что метод валентных связей позволяет объяснять процесс образования молекул неорганических и органических веществ. В качестве меры валентных связей используют число химических связей, которыми он соединяется с другими элементами.
Валентными электронами принято считать только те, которые располагаются на внешнем уровне. Данное утверждение актуально для элементов главных подгрупп. Если рассматривать элементы, располагающиеся в периодической системе в побочной подгруппе, то валентность будет определяться электронами, располагающимися на предвнешних энергетических уровнях.
При рассмотрении любой молекулы можно, воспользовавшись методом валентных связей, составить электронную формулу, а также предположить химическую активность и свойства соединения. В зависимости от того, какое количество облаков участвует в процессе, образуется разное число гибридных орбиталей. Это приводит к появлению одинарных, двойных, тройных связей в молекулах неорганических и органических веществ.
Вот мы вкратце и рассмотрели метод валентных связей, его положения.
Похожие статьи
- Неорганическая химия: понятие, вопросы и задачи. Что изучает неорганическая химия
- Принцип радиосвязи современной. Принципы радиосвязи и телевидения
- Метод конечных элементов и его применение
- Распределение биномиальное: определение, формула, примеры
- Энергетические уровни электрона в атоме. Объяснение квантования: корпускулярно-волновой дуализм
- Алканы: общие сведения. Физические и химические свойства алканов
- Каково распределение электронов по энергетическим уровням у разных химических элементов
