Модель атома Томсона: описание и опровержение
Модель атома Томсона – одна из ранних моделей строения атома, впоследствии признанная несостоятельной. Впервые предложена Д.Д. Томсоном в 1904 году вскоре после открытия электронов, но до открытия атомного ядра.
Предыстория
В 1897 году в физике произошло знаменательное событие: Томпсон Джозеф Джон открыл электроны, тем самым экспериментально подтвердив предположение, что атом не является «монолитной» частицей. Однако точного представления, что же из себя представляют элементарные частицы, не было. Лишь в 1911 году будет представлена более точная модель атома Резерфорда, а до этого научный мир лихорадочно бился над «загадкой столетия».

Поиск ответа
После серии экспериментов выяснилось, что электроны отрицательно заряжены, а между тем уже было известно, что атомы имеют нейтральный заряд. Томсон разумно предположил, что в атоме должен быть некий источник положительного заряда для компенсации отрицательного заряда электронов.
Английский физик представил три возможных механизма взаимодействия внутри частиц.
- В первой модели атома Томсона каждый отрицательно заряженный электрон прилипал к положительно заряженной частице, которая следовала за ним всюду внутри атома.
- Во второй модели электроны вращаются вокруг центральной области положительного заряда, имеющего такую же величину, что и все электроны.
- В третьей модели электроны занимали область пространства, которая сама была однородным положительным зарядом (часто рассматриваемым как «суп» или «облако» положительного заряда).
Ученый выбрал третий вариант - наиболее вероятную структуру атомов.

Внимание общественности
Модель атома Томсона в 1904 году была опубликована в мартовском выпуске Philosophical Magazine – авторитетном научном журнале Британии. По мнению автора, атомы элементов состоят из ряда отрицательно наэлектризованных корпускул (электронов), заключенных в сферу равномерной положительной электризации. Томсон отказался от более ранней своей гипотезы «туманного атома», в которой частицы состояли из нематериальных вихрей.
Публикация вызвала неподдельный интерес у научного сообщества. Однако прочных доказательств она не имела, а, следовательно, критиковалась многими авторитетными физиками. Впрочем, она соответствовала тем представлениям и экспериментальным данным, которые были известны на то время.
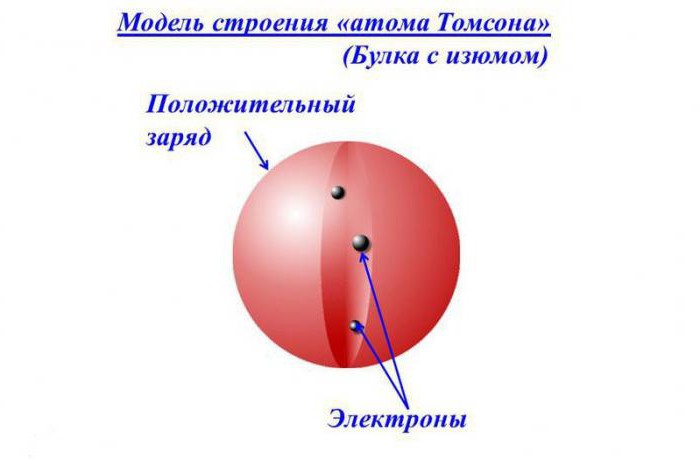
Описание модели
Будучи проницательным и практичным ученым, Томсон основывал свою атомную модель на известных экспериментальных данных. Предложение о положительном объеме заряда отражает характер его научного подхода к открытию, которое стало руководством к действию для будущих экспериментов.
Согласно теории, орбиты электронов внутри атомной модели Томсона были стабилизированы тем, что, когда электрон удалялся от центра положительно заряженной сферы (облака), он подвергался воздействию увеличивающейся силы притяжения. Эта сила возвращает электрон обратно, поскольку по закону Гаусса, внутри сферы более высокая концентрация положительного заряда. Согласно модели, электроны могли свободно вращаться по кольцам, которые были дополнительно стабилизированы взаимодействием между электронами, а спектроскопические значения объясняли энергетические различия между отдельными кольцевыми орбитами.
Согласно представлению того времени, электроны располагались в положительно заряженной сфере словно изюминки в пироге, или кусочки фруктов в любимом англичанами десерте – сливовом пудинге. Поэтому концепцию еще называют «пудинговой» моделью атома.
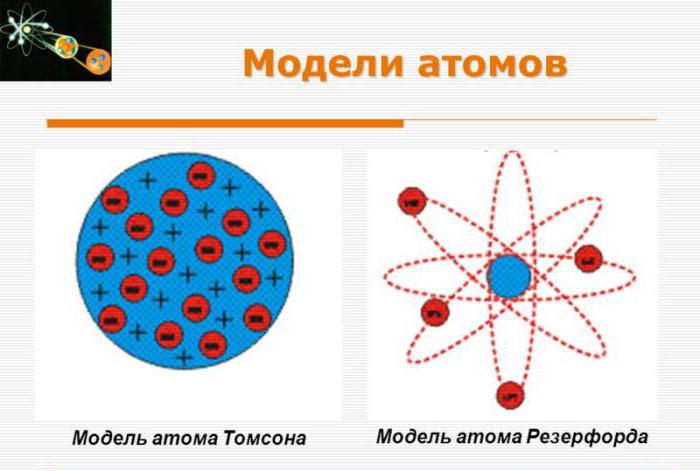
Дилемма несоответствия
По мере накопления экспериментальных данных все отчетливее наблюдалось несоответствие данной теории. Томсон безуспешно пытался переделать свою модель, чтобы объяснить некоторые из основных спектральных линий, экспериментально выявленных для нескольких элементов.
В 1909 году Ганс Гейгер и Эрнест Марсден под кураторством профессора Эрнеста Резерфорда провели эксперименты с тонким листом золота, рассеивая альфа-частицы на золотой фольге. Данные оказались отличными от ожидаемых. В 1911 году Резерфорд после долгих размышлений опубликовал собственную концепцию, названную впоследствии моделью атома Резерфорда. Он предположил наличие очень маленького ядра с сильнейшим положительным зарядом в центре атомов золота, достаточного для удержания порядка ста электронов.
Дальнейшее развитие
Сразу после того, как Резерфорд опубликовал свои результаты, Антониус Ван ден Брук интуитивно предположил, что атомный номер элемента представляет собой общее количество единиц заряда, присутствующих в его ядре. Генри Мозли в 1913 году предоставил необходимые данные для доказательства предложения Ван ден Брука. Было обнаружено, что эффективный ядерный заряд соответствует атомному номеру.
Данная работа послужила базисом для создания Нильсом Бором полуклассической модели атомов в 1913 году. Она напоминает взаимодействие светила и планет в Солнечной системе, но только с квантовыми ограничениями.

Значение для науки
Модель атома Томсона послужила толчком для стремительного развития ядерной физики. Концепция «сливового пудинга» с одним электроном использовалась физиком Артуром Эрихом Хаасом в 1910 году для оценки численного значения постоянной Планка и боровского радиуса атомов водорода. Работа Хааса была опубликована за три года до выводов Нильса Бора. Следует отметить, что боровская модель обеспечивает достаточно точные прогнозы для атомных и ионных систем, имеющих один эффективный электрон.
Кроме того, теория «пудинга» позволяет определить оптимальное распределение равных точечных зарядов на единичной сфере, называемой проблемой Томсона. Кстати, физическая система, воплощенная в проблеме Томсона, является частным случаем одной из восемнадцати нерешенных математических задач, предложенных математиком Стивом Смейлом – «Распределение точек на двумерной сфере».
Проблема Томсона является естественным следствием модели «пучкового пудинга» в отсутствие равномерного положительного фонового заряда. Электростатическое взаимодействие электронов, ограниченных сферическими квантовыми точками, также аналогично их обработке в атомной модели Томсона. В этой классической задаче квантовая точка моделируется как простая диэлектрическая сфера (вместо однородной, положительно заряженной сферы, как в модели «пучкового пудинга»), в которой находятся свободные или избыточные электроны.
Похожие статьи
- Планетарная модель атома: опыт Резерфорда
- Резерфорд Эрнест: биография, открытия и интересные факты
- Постулаты Бора: неоценимый вклад датского ученого в физику
- Эмма Томпсон: одна из величайших актрис современности
- Что такое атом? Из каких частей он состоит и в чем измеряется его масса?
- Метод конечных элементов и его применение
- Энергия фотона и ее использование
