Степень и константа гидролиза
Если рассматривать две главные отрасли химической науки, неорганическую и органическую химию, выясняется, что вы найдете у них не так уж много точек соприкосновения. Но есть один процесс истинно глобального масштаба, который объединяет неорганические и органические вещества. Это процесс гидролиза.
Вода – универсальный растворитель
Гидролиз – это взаимодействие веществ с водой, при котором составные части химических соединений образуют продукты реакции с ионами водорода и гидроксогрупп молекул H2O. Учитывая, что 79 % планеты и до 80 % от массы всех живых организмов составляет вода, становится понятно, что реакции гидролиза охватывают все проявления природных процессов, начиная разрушением горных пород и заканчивая метаболизмом на всех семи уровнях организации живой материи, начиная от молекулярного и до биосферного.

Математический язык гидролиза
Чем сложнее химический процесс, тем большего количества формул и расчетов он требует. Для обоих видов обменных реакций веществ с водой как в органической, так и в неорганической химии используют математические величины – это степень и константа гидролиза, обозначаемые как αг и Kг. Их значения вычисляют и применяют в технологических процессах органического синтеза, например, при осахаривании крахмала, гидролизе древесины, омылении жиров.
Что такое степень гидролиза
Чем быстрее вещество взаимодействует с водой, тем больше в таком растворе будет его гидролизованных молекул. Отношение их числа к общем количеству частиц химического соединения в растворе и называется степенью гидролиза. В неорганической химии её принято обозначать как h, в органической αг. Ее выражают в частях от единицы или в процентах. Например, если в воде будет растворено 2 моль вещества, а прогидролизовало 0,01 моль, то h=0,01/2=0,005 или 0,5 %.

Константа гидролиза
Эта величина показывает способность вещества гидролизоваться. Чем она выше, тем быстрее молекулы растворяемого вещества взаимодействуют с ионами водорода и гидроксильных групп воды. Её обозначают как Кг, выражение для константы гидролиза может быть представлено формулой:
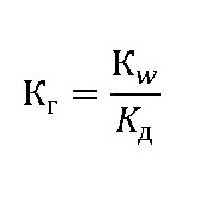
где: Kw – ионное произведение воды [H+]*[OH-];
Kд– константа диссоциации (расщепления) растворяемого вещества.
Для органических соединений степень и константа гидролиза связаны с формулой:
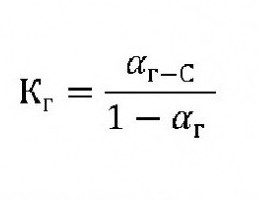
где:
Кг– константа гидролиза.
С – концентрация ионов растворенного вещества.
αг– степень гидролиза.
Особенности гидролиза органических соединений
Обменные реакции с водой у белков, углеводов и жиров протекают многоступенчато и достаточно сложно. Поэтому и константа гидролиза, формула которой:
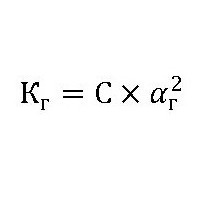
где: С – концентрация растворенного вещества (моль/л).
αг– степень гидролиза, будет также зависеть еще и от природы катализатора (фермента), его активности и от температуры раствора.
Например, в технологическом процессе обменных реакций целлюлозы с водой специалисты просчитывают все параметры, главными из которых являются константа гидролиза и константа скорости гидролиза. Для последней величины вводят такие составляющие, как: α– относительную активность катализатора, N – его нормальность, то есть концентрацию, b – способность целлюлозы к гидролизу и λ – показатель, характеризующий зависимость скорости реакции с водой от температуры: k=α*N*b*λ

В реакциях гидролиза жиров химики-технологи учитывают её обратимость. Чтобы сдвинуть равновесие вправо, в сторону образования нужных продуктов, например, глицерина, в промышленном синтезе применяют щелочи. В этом случае гидролиз жиров проходит практически до конца: гидроксиды натрия или калия превращают многоосновные карбоновые кислоты, которые образуются в соли и таким образом препятствуют прохождению обратной реакции образования жира. Подобным способом пользуются при разложении водой сложных эфиров в реакции омыления. Увеличивая концентрацию гидроксид-ионов и разбавляя реагирующую смесь, добиваются повышения степени гидролиза α, а значит, и выхода продуктов реакции спиртов и органических кислот.
Разложение водой неорганических веществ
Практическое значение имеют реакции гидролиза химических соединений, относящихся к классу солей. Они, как известно, являются продуктами обмена между кислотами и основаниями. Так вот, их гидролиз будет зависеть как раз от того, какими именно гидроксидами и кислотами образованы соли. И ключевым здесь будет понятие теории электролитической диссоциации о силе электролитов. Константа и степень гидролиза солей также будут изменяться, в зависимости от состава ионов, образующих их молекулы.

Почему pH солей различен
Опыты показывают, что растворы различных солей могут быть кислыми (рН<7), нейтральными (рН=7), или щелочными (рН>7), хотя в их молекулах нет ни водородных, ни гидроксильных ионов. Объяснение этим противоречиям нужно искать в процессе их реакции с водой:
Соль+вода <=> кислота + основание.
Этому равновесию соответствует константа гидролиза:
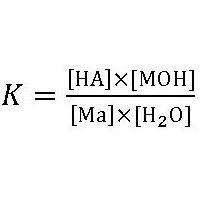
где: НА – кислота,
МОН – основание,
МА – соль.
Исходя из того, что концентрация воды в разбавленных растворах есть постоянной, константа гидролиза будет иметь вид:
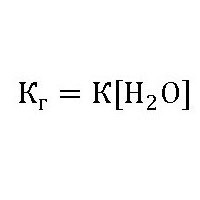
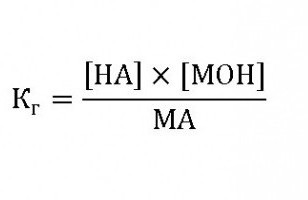
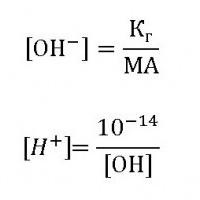

Степень гидролиза и ТЭД
В свете теории электролитической диссоциации равновесие процесса гидролиза зависит от уже известной нам величины h или αг – степени гидролиза. Если водой разлагается соль слабой кислоты, например Na2CO3 или К2S, то
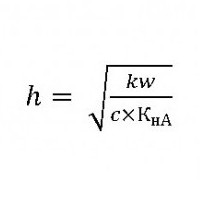

Катионы натрия не могут связать ионы ОН- в молекулы гидроксида натрия, так как он является сильным электролитом и в растворе никогда не присутствует как молекула. В то же время карбонат-ионы связываются с Н+ с образованием слабого электролита – угольной кислоты - до тех пор, пока в растворе не установится равновесие.
При гидролизе солей слабых оснований AlCl3, FeSO4:
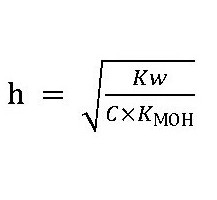

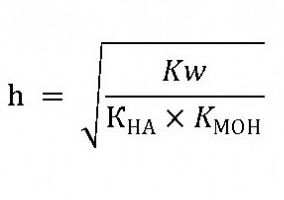
Добавим также следующее:
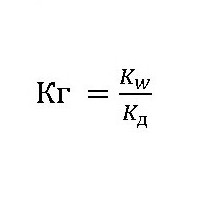
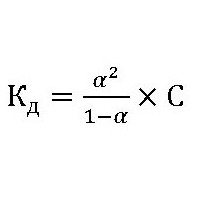
Вычисление константы гидролиза хлорида аммония
Чтобы определить эту величину слабым основанием и сильной кислотой, используем соотношение:
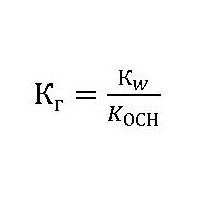
КОСН – константа диссоциации образующегося при гидролизе слабого основания NH4ОН.
Тогда константа гидролиза хлорида аммония будет равна:
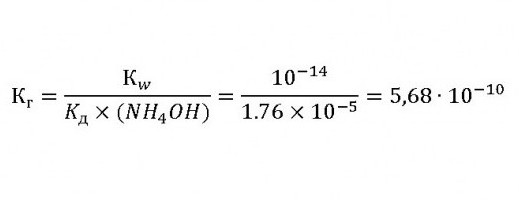
Это доказывает, что при гидролизе раствор этой соли имеет кислую реакцию.
Похожие статьи
- Степень диссоциации, электролиты и положения теории электролитической диссоциации
- Электролитическая диссоциация: уравнение, степень, константа, реакции
- Молярная концентрация растворов. Что такое массовая концентрация раствора?
- Сульфат аммония: формула, состав, получение и применение
- Эндотермическая реакция - это реакция с поглощением тепла
- Что такое крахмал? Свойства и применение
- Каталитические реакции: определение, описание, примеры
