Эндотермическая реакция - это реакция с поглощением тепла
Экзотермические и эндотермические реакции связаны с выделением либо поглощением энергии во время протекания определенного процесса. Рассмотрим детальнее вопросы, связанные с химической кинетикой.

Особенности экзотермических процессов
При взаимодействии негашеной извести (оксида кальция) с водой образуется гашеная известь (гидроксид кальция). Этот процесс сопровождается выделением значительного количества энергии. Это пример экзотермической реакции. Также с выделением энергии происходит процесс разбавления серной кислоты. Учитывая, что в реакции выделяется достаточно существенное количество тепла, необходимо при разбавлении этого вещества добавлять кислоту в воду тонкой струйкой. При горении всех органических веществ наблюдается выделение энергии, следовательно, они являются экзотермическими процессами.
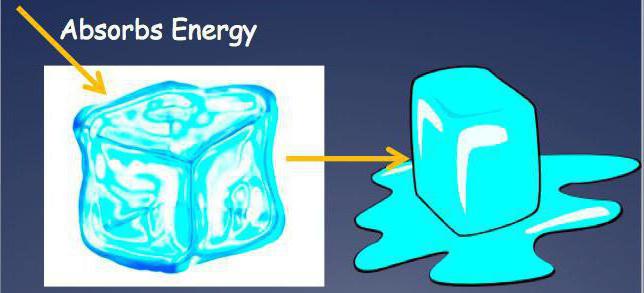
Специфика эндотермических процессов
Любая эндотермическая реакция - это процесс, для осуществления которого необходимо предварительное нагревание исходной смеси. Например, в промышленных масштабах осуществляют процесс превращения известняка (карбоната кальция) в негашеную известь (оксид кальция) и водяной пар. Такая эндотермическая реакция - это типичный вариант разложения, нуждающегося в предварительном нагревании. Несмотря на дополнительные затраты, процесс является экономически обоснованным, поэтому используется для получения оксида кальция, являющегося важным химическим сырьем.
Кроме того, эндотермической является реакция разложения перманганата калия. При постоянном нагревании исходное вещество превращается в манганат калия, оксид марганца (4). Самым важным из продуктов этого взаимодействия является кислород.
Эндотермическая реакция - это процесс, который протекает с поглощением значительного количества теплоты.

Обозначения теплового эффекта
Те химические взаимодействия, которые связаны с выделением реакции, предполагают указание знака «+». Эндотермическая реакция - это процесс, показываемый в уравнении знаком «-». В современной химии существует специальная отрасль, которая занимается изучением всех тепловых реакций, это термохимия. Для того чтобы показать количество теплоты, поглощаемой либо выделяемой в ходе взаимодействия различных компонентов, введено понятие теплового эффекта. Он имеет противоположное по знаку значение количеству теплоты.
Ученым в ходе многочисленных экспериментов удалось доказать, что абсолютно все взаимодействия связаны с тепловым эффектом. Если его показатель незначителен, в таком случае увидеть его практически невозможно, это чаще всего характерно для экзотермических взаимодействий. При этом нельзя не увидеть эндотермические реакции. Примеры подобных процессов, приведенные выше, подтверждают необходимость предварительной затраты тепла.

Химическая кинетика
Она представляет собой учение о тех явлениях, которые касаются взаимодействия веществ. Именно в данной отрасли химии объясняется механизм протекания процесса, скорость взаимодействия, а также условия осуществления заданной реакции. Химическая термодинамика дает возможность проводить различные математические расчеты, связанные с выявлением возможности самостоятельного протекания процесса. Для этого используют параметры начального и конечного состояния системы, применяют закон Гесса. Исследование кинетики протекания реакций позволяет развивать современные химические отрасли, рационально использовать выделяющую при взаимодействии энергию.
Представление о тепловом эффекте процесса исследователи используют для разработки инновационных способов получения препаратов и компонентов. Например, именно эндотермические процессы помогают сохранять определенные реагенты, применяемые в современной косметологии. Без экзотермических превращений невозможен обогрев жилых помещений, промышленных предприятий. Для того чтобы провести оценку эффективности теплового процесса, в химической кинетике осуществляют специальные вычисления, они базируются на основных законах термодинамики.
Похожие статьи
- "Гепатовет" для собак: инструкция по применению, отзывы
- Каталитические реакции: определение, описание, примеры
- Что такое дебаты? Их виды
- Типы химических реакций. Классификация химических реакций
- Принцип Ле Шателье в химии
- Опыты в домашних условиях по химии и физике. Опыты для детей
- Химическая формула озона
