Степень диссоциации, электролиты и положения теории электролитической диссоциации
Данная статья посвящена таким понятиям, как электролиты и степень диссоциации, а также описанию теории, объясняющей механизмы проведения электрического тока растворами различных веществ.
Все ли вещества проводят ток
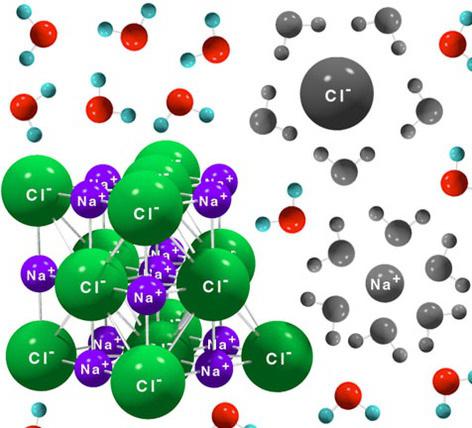
Многие соединения, если их растворить в воде или расплавить, обладают способностью проводить электрический ток. Например, общеизвестно, что водный раствор поваренной соли хорошо проводит электричество. Аналогичным свойством обладает и расплав хлористого натрия. Все вещества, которые в растворах или расплавах проводят ток, объединены под названием электролиты. Неэлектролиты – это соединения, которые не обладают способностью проводить электрический ток в растворах и расплавах. Другое определение электролитов позиционирует их как вещества, которые распадаются на ионы в растворах или расплавах. А вот растворы многих других соединений, напротив, не могут проводить электричество. К примеру, раствор сахара, а также большинство органических веществ. Наглядно увидеть движение тока через раствор электролита позволяет следующий опыт. К электрической цепи подсоединены два электрода. Если их опустить в раствор электролита и замкнуть цепь, то лампочка загорается. Обратную картину можно наблюдать используя раствор неэлектролита.

Какие это вещества
К электролитам относятся такие классы веществ, как основания, кислоты и подавляющее большинство солей. К неэлектролитам причисляют практически все органические соединения, а также вещества, молекулы которых обладают лишь ковалентными неполярными связями. Электролиты очень часто называют проводниками второго рода. Почему? Дело в том, что сами по себе, не находясь в состоянии расплава или раствора, эти соединения не могут выступать проводниками электрического тока. Свои свойства они проявляют лишь в растворах. Связано это с тем, что при растворении молекулы электролитов распадаются на ионы, которые и становятся переносчиками, транспортировщиками электрического заряда. А находясь в составе молекулы, они теряют подобные свойства. Именно этим и объясняется то, что дистиллированная вода не проводит ток.

Сильные электролиты
Такие вещества, как электролиты, разделяются на две большие группы. Это сильные и слабые электролиты. Чем эти вещества отличаются друг от друга? Сильные электролиты полностью распадаются на ионы при растворении в воде. Например, тот же хлорид натрия. К таким веществам относятся практически все соли, основания активных металлов – щелочных и щелочноземельных, которые находятся в первых двух группах периодической системы Д. И. Менделеева, например калий, натрий, магний, и большинство неорганических кислот. Например, сильными электролитами являются серная, азотная, соляная, бромоводородная и многие другие кислоты.
Слабые электролиты
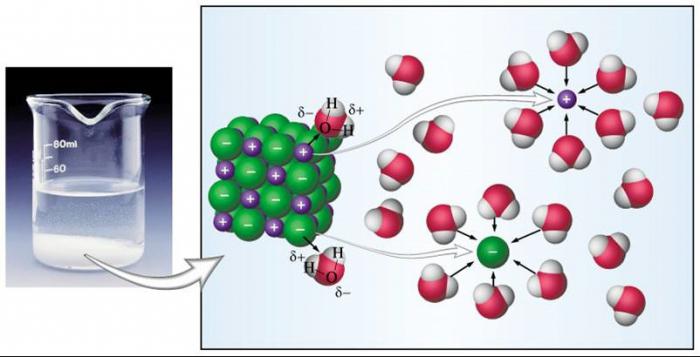
Что касается соединений, которые в водном растворе распадаются на ионы лишь частично, то они называются слабыми электролитами. Стоит упомянуть, что к таким веществам причисляют подавляющее большинство органических кислот (уксусная, лимонная, молочная, щавелевая и другие), небольшое количество неорганических кислот (угольная, азотистая, кремниевая и прочие), основания всех металлов, за исключением щелочных и щелочноземельных. Вода также относится к слабым электролитам. Концентрация ионов для таких соединений весьма невелика.
Теория электролитической диссоциации
Свойства веществ, описанные выше, были замечены химиками и физиками уже давно. Шведский ученый Сванте Август Аррениус разработал теорию электролитической диссоциации для того, чтобы объяснить поведение электролитов в водных растворах, чтобы описать механизм растворения. Он положил хорошее начало, а его последователи в дальнейшем обобщили и дополнили эту теорию, которая не утратила своей справедливости до настоящего времени. В растворах молекулы электролитов распадаются на частицы, обладающие положительным либо отрицательным зарядом. Этот процесс ученый назвал электролитической диссоциацией. В основе учения Аррениуса находятся три положения. Рассмотрим каждое из них.

Положение первое
Электролиты в процессе растворения или расплавления распадаются на отрицательно и положительно заряженные частицы – ионы. Они могут быть простыми и сложными. Примеры простых ионов – К+, Mg2+, Na+. К сложным можно отнести SO42-, NO3- и другие.
Положение второе
Воздействие электрического тока приводит к тому, что ионы начинают двигаться в определенном направлении. При таком движении отрицательно заряженные частицы движутся к аноду, а положительно заряженные – к катоду. В связи с этим первые получили название анионов, а вторые – катионов. Почему происходит направленное движение ионов? Это связано с тем, что противоположно заряженные электроды притягивают к себе соответствующие частицы.
Положение третье
Диссоциация – это обратимый процесс, поскольку одновременно с распадом одних молекул на ионы происходит образование других за счет соединения ионов (так называемая ассоциация). Этот процесс очень динамичный, и распад одних молекул постоянно сменяет соединение других. Теория, заложенная С. Аррениусом, стала одной из важнейших теорий современной неорганической химии.
Механизм диссоциации
Ионная связь является определяющей в способности вещества диссоциировать на ионы в водном растворе. Соединения с таким типом связи в своих молекулах распадаются быстрее и легче остальных веществ. Каждая молекула воды имеет два противоположно заряженных полюса или диполя. С одной стороны – кислород, с другой – водород. Благодаря такому распределению зарядов в молекуле воды и происходит распад на ионы растворяемых соединений, которые являются электролитами. Ионы, из которых состоят молекулы таких электролитов, при диссоциации притягиваются диполями воды, которые как бы окружают каждый ион, отщепляя его. Такой механизм основан на силах взаимного притяжения противоположных зарядов. Ионы, окруженные молекулами воды, получили название гидратированных. По такому же принципу происходит диссоциация веществ, имеющих полярную ковалентную связь в своих молекулах. Но если ионные вещества распадаются полностью, то среди полярных электролитов много и таких, которые диссоциируют частично.

Степень диссоциации
Итак, электролиты – это вещества, атомы в молекулах которых связаны либо ионной, либо ковалентной полярной связью. Основные группы таких соединений – это кислоты, соли и основания. Кислоты диссоциируют с образованием ионов водорода и кислотного остатка, основания – ионов металла и гидроксильной группы, соли – ионов металла и кислотного остатка. Согласно третьему положению электролитической диссоциации, распад электролита на ионы – обратимый процесс. Значит в растворе присутствуют и отдельные ионы, и целые молекулы. Это позволило ученым ввести такую величину, как степень диссоциации. Она является отношением количества распавшихся на ионы молекул n к общему числу молекул электролита N. Степень диссоциации имеет свое обозначение – α. Все это можно выразить формулой α=n/N. Чем больше молекул распалось на ионы, тем большее значение принимает степень диссоциации. А что же будет, если все молекулы электролита распадаются на ионы? В таких случаях степень диссоциации будет равна единице, и это наибольшее значение, которое она может принимать. Как правило, это характерно для сильных электролитов, которые полностью распадаются на ионы в водном растворе. Помимо доли, единицы константа и степень диссоциации могут выражаться в процентах. Это число зависит не только от природы электролита, но и таких условий, как температура раствора и его концентрация. Константа диссоциации – это отношение концентраций ионов электролита в растворе к концентрации целых молекул. Кроме того, для растворов сильных электролитов введено такое понятие, как кажущаяся степень диссоциации. Дело в том, что растворы сильных электролитов не имеют нераспавшихся на заряженные частицы молекул, а такой раствор обладает особой ионной структурой, которая несколько изменяет его свойства. Поэтому к нему неприменима обычная степень диссоциации. Кажущуюся степень диссоциации можно понимать как условную, поскольку отменить эту величину для растворов сильных электролитов нельзя, но в то же время ее значение практически всегда остается неизменным, не отклоняясь от единицы.
Похожие статьи
- Степень и константа гидролиза
- Гидролиз солей. Какие соли подвергаются гидролизу
- Электролитическая диссоциация: уравнение, степень, константа, реакции
- Теория электролитической диссоциации — одна из основных в химии
- Химическое равновесие и создание условий для его смещения
- Коллоидные растворы: методы получения и использование
- Основные классы неорганических соединений
