Особенности строения атома водорода

Самый распространенный элемент в космосе, состоящий из самых легких атомов, - это водород. Он открыт еще в 14 столетии великим алхимиком Парацельсом. Ученого по праву считают основоположником не только медицины, но и химии. Строение атома водорода было в дальнейшем детально рассмотрено Нильсом Бором. Элемент был затем обнаружен астрономами в составе Солнца и других планет, а также в газовых звездных туманностях. В них происходит процесс превращения атомов водорода в атомы гелия, иными словами, наблюдается ядерная реакция. В нашей статье мы изучим не только строение атома водорода, но и рассмотрим характерные особенности свойств этого химического элемента.
Место элемента в периодической системе Менделеева
Водород – единственный химический элемент, находящийся сразу в двух группах периодической системы: 1 и 7. Объяснить следующий факт можно так: он проявляет двойственные химические свойства. Особое строение атома водорода позволяет ему отдавать свой единственный электрон атомам, например, активных элементов – неметаллов. Это прежде всего галогены: агрессивные по своим свойствам фтор, хлор, бром и йод. Легко взаимодействует H2 и с халькогенами: серой, кислородом, селеном. В этом случае атомы водорода превращаются в катионы – положительно заряженные частицы.
Благодаря этой особенности элемент занимает место в первой группе периодической системы. Иначе выглядит механизм реакции между металлами и водородом. Согласно теории строения атома водорода по Н. Бору, элемент имеет один неспаренный электрон. Атом H принимает электроны от атомов активных щелочных или щелочноземельных металлов. Таким образом, его электронная конфигурация становится похожей на частицу инертного газа гелия. Единственный энергетический слой теперь полностью завершен. В данных процессах строение атома водорода изменяется и он переходит в форму аниона. Именно по этой причине элемент одновременно располагается в периодической системе еще и в ее 7 группе.

Все в сравнении
Продолжая изучать особенности строения водородных частиц, давайте посмотрим, насколько их внутренняя структура влияет на поведение элемента в реакциях. Для этого обратим внимание на его ближайших соседей по периодической системе и определим, каково строение атомов водорода, гелия и лития. С частицами инертного газа водород объединяет одинаковое количество энергетических уровней, с литием – похожее строение внешнего энергетического слоя, на котором расположен один электрон. Однако свойства водорода сильно отличаются как от инертного газа, так и от щелочного металла. Этот факт доказывает, что все характеристики химического элемента полостью определяются строением атома и молекулы водорода, то есть количеством энергетических уровней и распределением электронов на них.
Рождающий воду
Название элемента говорит о том, что соединение его атомов с частицами кислорода приводит к появлению такого уникального и важного для Земли вещества, как вода. В обычных условиях эта реакция не происходит, температура горения газовой смеси достигает 2800 °C. В лаборатории взаимодействие между H2 и O2 в соотношении 2:1 приводит к взрыву. Сама смесь получила название гремучего газа, а процесс, протекающий в ней, идет по свободно-радикальному механизму. Если его не контролировать, то реакция заканчивается серьезной проблемой – мощным взрывом. По этой причине, несмотря на его исключительную легкость, от водорода отказались как от наполнителя для воздушных летательных аппаратов. Печальным поводом послужило крушение в 1937 году дирижабля "Гинденбург", направлявшегося в Америку. Посмотрим теперь, как строение атома водорода влияет на физические признаки газа.

Водород, дейтерий, тритий
Пусть вас не удивляет приведенный выше перечень терминов. Речь идет все об одном и том же химическом элементе водороде, заряд ядра атома которого равен +1. Второе и третье названия – это имена изотопов. Причина их различий заключается в количестве нейтронов в ядре, тогда как протонное число всех трех видов частиц одинаково. У дейтерия два нейтрона, у трития – 3, сам же водород имеет 1 нейтрон в составе своего ядра. Вода, содержащая в составе своих молекул дейтерий, называется тяжелой. Ее можно обнаружить в прудах-охладителях атомных станций, а также в составе цитоплазмы клеток, имеющих нарушения нормального метаболизма.
Электронное строение атома водорода
Схема, приведенная ниже, поможет нам понять специфику поведения простого вещества H2 в различных химических взаимодействиях.
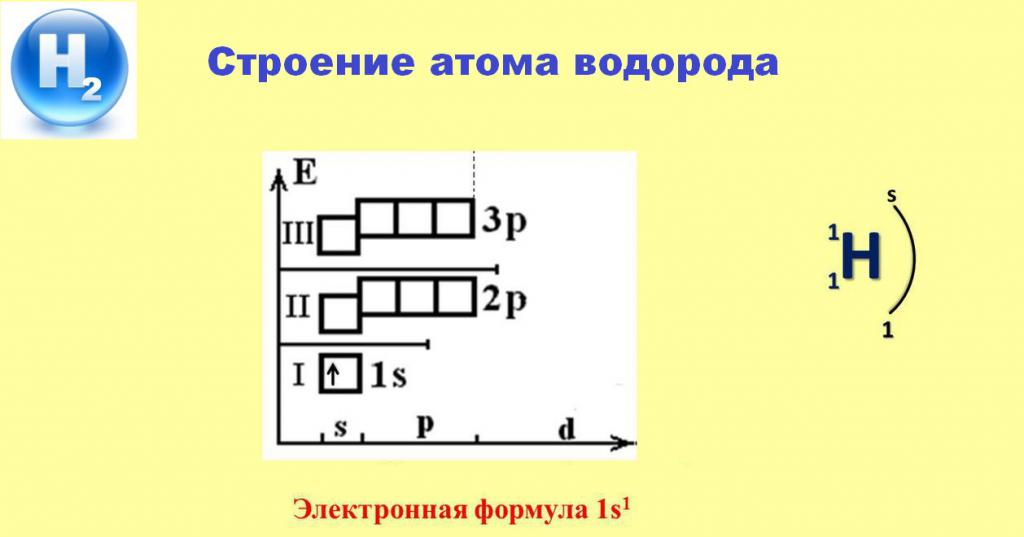
Наличие единственного электрона, занявшего s-орбиталь первого энергетического уровня, обеспечивает постоянную валентность водорода, равную 1. В большинстве случаев этот электрон покидает пространство атома и переходит во владение более электроотрицательных элементов. Лишь реакции с металлами позволяют водороду притянуть в сферу влияния собственного ядра электрон от атомов активных щелочных или щелочноземельных элементов, образуя белые кристаллические соединения - их гидриды.
Активный и агрессивный
Атомарный водород, так сказать, легок на подъем. Его быстроте в восстановлении металлов из их оксидов могут позавидовать другие восстановители вроде углерода или его окислов. Так же активно атомы H соединяются с частицами серы, кислорода, фосфора. А пламя горелки с атомарным водородом дает разогрев выше 4000 °C. По этой причине такими приборами легко обрабатывать поверхности металлов: резать или сваривать их.

Атомарный водород хорошо зарекомендовал себя в качестве восстановителя чистых металлов - вольфрама, молибдена - из их руд, представленных в основном оксидами. Встречаясь с такими же атомами, как и он сам, водород образует устойчивую и пассивную структуру – молекулу. Оба атома H держатся друг за друга с помощью общей электронной пары, являясь образцом стабильной ковалентной неполярной связи. Она прочная и обеспечивает устойчивость молекул H2 как в условиях земного существования, так и на просторах космоса. Не обошлась без водорода и пищевая промышленность, в которой его применяют для гидрогенизации масел и получения модных в современной диетологии низкокалорийных спредов.

В нашей статье мы рассмотрели, каково строение атома водорода, и выяснили, как оно влияет на свойства простого вещества
Похожие статьи
- Зачем нужна география в жизни? Зачем нужно изучать географию?
- Какие бывают предложения по цели высказывания и по интонации? Виды предложений по цели высказывания
- Информатика – это наука... Что изучает информатика?
- Простое предложение. Виды простых предложений
- Практическое значение биологии в жизни человека, в медицине, в пищевой промышленности
- Речь: классификация речи, виды и стили речи. Устная и письменная речь
- Пунктуационный разбор предложения: легко и просто
