Идея атома как мельчайшей частицы, из которой состоит все сущее, была рождена еще мыслителями античной Греции. Однако лишь в конце XVIII века физиками было доказано, что подобные частицы действительно существуют. Весь XIX век стал эпохой развития представлений об атоме, его свойствах и строении. Так, в 1830-х Майкл
Фарадей открыл тот факт, что мельчайшие частицы имеют заряды, благодаря чему человечеству были оглашены свойства
электрического тока. В 1880-х Иоганном Бальмером была установлена математическая связь между видимой частью спектра и
длиной волны излучения. В 1890-х Антуан Беккерель открыл явление радиоактивного излучения. Однако внутреннее
строение атома долгое время оставалось загадкой для лучших мировых умов. А ведь известные к тому времени свойства этих частиц свидетельствовали о достаточно сложном устройстве микромира. Ответом на этот вопрос был призван стать опыт Резерфорда. Первый эксперимент этого британского физика был выполнен в районе 1909 - 1911 годов.
Опыт Резерфорда
Ученый придумал осуществить зондирование атома посредством альфа-частиц, возникающих при радиоактивном распаде. Опыт Резерфорда заключался в том, что изучаемые атомы тяжелых элементов (серебро, золото и т. д.) буквально бомбардировались альфа-частицам, идентичными ядру атома гелия.

Вследствие столкновений альфа-частицы разлетались в стороны, а наблюдение за их поведением многое говорило о строении атомов тяжелых элементов. Альфа-частицы выпускались из источника, помещенного в свинцовую полость, и направлялись на атом Резерфорда. Все эти частицы поглощались свинцовой стенкой сосуда, кроме тех, которые двигались вдоль специально отведенного канала и попадали на золотую фольгу (состоявшую в своей структуре, разумеется, из атомов). Опыт Резерфорда продемонстрировал, что при попадании альфа-частиц на такую фольгу происходят кратковременные световые вспышки (сцинстилляции). После длительного наблюдения за поведением альфа-частиц ученым был сделан вывод о том, что весь положительный атомный заряд сосредоточен в его ядре, компактном, но все же массивном. Электроны же (отрицательно заряженные мельчайшие частицы) вращаются по орбите вокруг ядра атома. Следует отметить, что модель Резерфорда существенно преобразила представления физиков того времени о квантовом мире. Ведь все предыдущие взгляды основывались на экспериментах Джона Томсона, который утверждал, что атом представляет собой некоторую, положительно заряженную субстанцию ("суп", по его собственную выражению), в которой «плавают» вкрапления отрицательно заряженных тел – электронов.
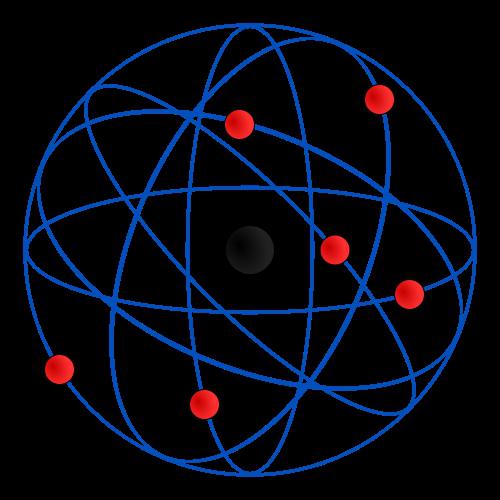
Интересно, что конструкция Резерфорда в скором времени стала называться планетарной моделью атома из-за своего сходства с вращением тел в Солнечной системе. Движение планет вокруг Солнца сильно напоминают вращение электронов вокруг ядра, хотя позднее, с появлением квантовой механики, было обнаружено, что в микромире действуют совсем другие законы, а за это вращение ответственна вовсе не гравитация.



