Ионная связь. Способ образования и свойства
В химических реакциях электроны от одного атома могут полностью перейти к другому. Такое перераспределение зарядов ведет к образованию положительно и отрицательно заряженных ионов (катионов и анионов). Между ними возникает особый тип взаимодействия — ионная связь. Рассмотрим подробнее способ ее образования, строение и свойства веществ.
Электроотрицательность
Атомы отличаются по электрооотрицательности (ЭО) — способности притягивать к себе электроны с валентных оболочек других частиц. Для количественного определения используется предложенная Л. Поллингом шкала относительной электроотрицательности (безразмерная величина). Сильнее, чем у других элементов, выражена способность притягивать к себе электроны у атомов фтора, его ЭО — 4. В шкале Поллинга сразу же за фтором следуют кислород, азот, хлор. Значения ЭО водорода и других типичных неметаллов равны или близки к 2. Из металлов большинство обладает электроотрицательностью от 0,7 (Fr) до 1,7. Существует зависимость ионности связи от разности ЭО химических элементов. Чем она больше, тем выше вероятность того, что возникнет ионная связь. Этот тип взаимодействия чаще встречается при разности ЭО=1,7 и выше. Если значение меньше, то соединения относятся к полярным ковалентным.
Энергия ионизации
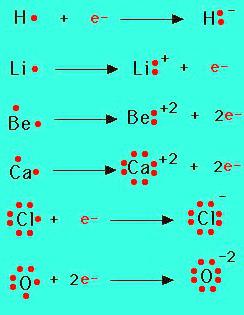
Для отрыва слабо связанных с ядром внешних электронов необходима энергия ионизации (ЭИ). Единица изменения этой физической величины — 1 электрон-вольт. Существуют закономерности изменения ЭИ в рядах и столбцах периодической системы, зависящие от возрастания заряда ядра. В периодах слева направо энергия ионизации увеличивается и приобретает наибольшие значения у неметаллов. В группах она уменьшается сверху вниз. Основная причина — увеличение радиуса атома и расстояния от ядра до внешних электронов, которые легко отрываются. Возникает положительно заряженная частица — соответствующий катион. По величине ЭИ можно судить о том, возникает ли ионная связь. Свойства также зависят от энергии ионизации. Например, металлы щелочные и щелочноземельные обладают небольшими значениями ЭИ. У них ярко выражены восстановительные (металлические) свойства. Инертные газы в химическом отношении малоактивны, что обусловлено их высокой энергией ионизации.
Сродство к электрону
В химических взаимодействиях атомы могут присоединять электроны с образованием отрицательной частицы — аниона, процесс сопровождается выделением энергии. Соответствующая физическая величина — это сродство к электрону. Единица измерения такая же, как энергии ионизации (1 электрон-вольт). Но ее точные значения известны не для всех элементов. Галогены обладают наибольшим сродством к электрону. На внешнем уровне атомов элементов — 7 электронов, не хватает только одного до октета. Сродство к электрону у галогенов высокое, они обладают сильными окислительными (неметаллическими) свойствами.
Взаимодействия атомов при образовании ионной связи
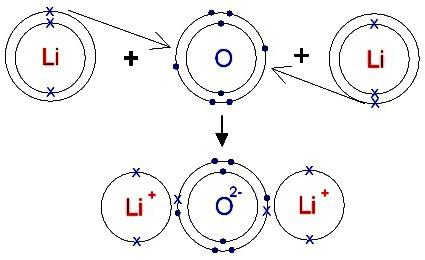
Атомы, имеющие незавершенный внешний уровень, находятся в неустойчивом энергетическом состоянии. Стремление к достижению стабильной электронной конфигурации — основная причина, которая приводит к образованию химических соединений. Процесс обычно сопровождается выделением энергии и может привести к молекулам и кристаллам, отличающимся по строению и свойствам. Сильные металлы и неметаллы значительно различаются между собой по ряду показателей (ЭО, ЭИ и сродству к электрону). Для них больше подходит такой тип взаимодействия, как ионная химическая связь, при которой перемещается объединяющая молекулярная орбиталь (общая электронная пара). Считается, что при образовании ионов металлы полностью передают электроны неметаллам. Прочность возникшей связи зависит от работы, необходимой для разрушения молекул, составляющих 1 моль исследуемого вещества. Эта физическая величина известна как энергия связи. Для ионных соединений ее значения составляют от нескольких десятков до сотен кДж/моль.
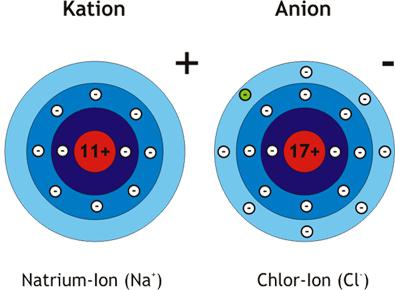
Образование ионов
Атом, отдающий свои электроны при химических взаимодействиях, превращается в катион (+). Принимающая частица — это анион (–). Чтобы выяснить, как будут вести себя атомы, возникнут ли ионы, нужно установить разность их ЭО. Проще всего провести такие расчеты для соединения из двух элементов, например, хлорида натрия.
- ЭО (Cl) = 3,16;
- ЭО (Na) = 0,99;
- 3,16 – 0,99 =2,17.
- 2,17 больше, чем 1,7, — возникает ионная связь.
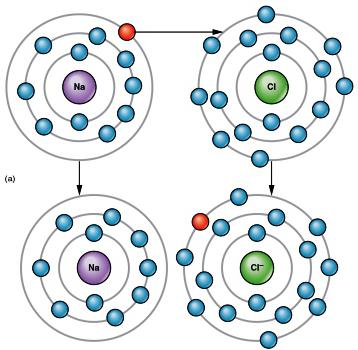
Натрий имеет всего 11 электронов, конфигурация внешнего слоя — 3s1. Для его завершения атому легче отдать 1 электрон, чем присоединить 7. Строение валентного слоя хлора описывает формула 3s23p5. Всего у атома 17 электронов, 7 — внешних. Не хватает одного для достижения октета и стабильной структуры. Химические свойства подтверждают предположения о том, что атом натрия отдает, а хлор принимает электроны. Возникают ионы: положительный (катион натрия) и отрицательный (анион хлора).
Ионная связь
Теряя электрон, натрий приобретает положительный заряд и устойчивую оболочку атома инертного газа неона (1s22s22p6). Хлор в результате взаимодействия с натрием получает дополнительный отрицательный заряд, а ион повторяет строение атомной оболочки благородного газа аргона (1s22s22p63s23p6). Приобретенный электрический заряд называется зарядом иона. Например, Na+, Ca2+, Cl-, F-. В составе ионов могут находиться атомы нескольких элементов: NH4+, SO42-. Внутри таких сложных ионов частицы связаны по донорно-акцепторному или ковалентному механизму. Между разноименно заряженными частицами возникает электростатическое притяжение. Его величина в случае ионной связи пропорциональна зарядам, а с увеличением расстояния между атомами оно слабеет. Характерные признаки ионной связи:
- сильные металлы реагируют с активными неметаллическими элементами;
- электроны переходят от одного атома к другому;
- возникшие ионы обладают стабильной конфигурацией внешних оболочек;
- между противоположно заряженными частицами возникает электростатическое притяжение.
Кристаллические решетки ионных соединений
В химических реакциях металлы 1-й, 2-й и 3-й групп периодической системы обычно теряют электроны. Образуются одно-, двух- и трехзарядные положительные ионы. Неметаллы 6-й и 7-й групп обычно присоединяют электроны (исключение — реакции с фтором). Возникают одно- и двухзарядные отрицательные ионы. Затраты энергии на эти процессы, как правило, компенсируются, при создании кристалла вещества. Ионные соединения обычно находятся в твердом состоянии, образуют структуры, состоящие из противоположно заряженных катионов и анионов. Эти частицы притягиваются и образуют гигантские кристаллические решетки, в которых положительные ионы окружены отрицательными частицами (и наоборот). Суммарный заряд вещества равен нулю, ведь общее число протонов уравновешивается количеством электронов всех атомов.
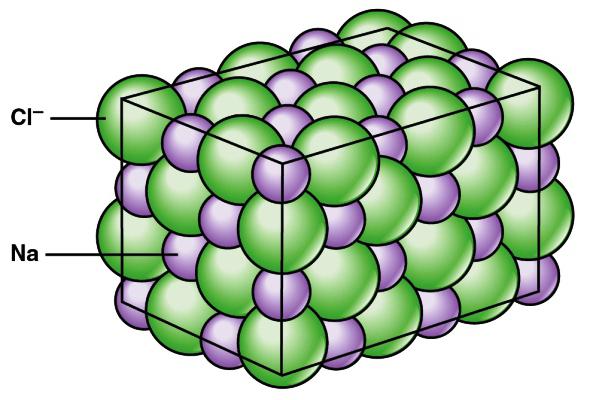
Свойства веществ с ионной связью
Для ионных кристаллических веществ характерны высокие температуры кипения и плавления. Обычно эти соединения являются термостойкими. Следующую особенность можно обнаружить при растворении таких веществ в полярном растворителе (воде). Кристаллы легко разрушаются, а ионы переходят в раствор, который обладает электрической проводимостью. Ионные соединения также разрушаются при расплавлении. Появляются свободные заряженные частицы, значит, расплав проводит электрический ток. Вещества с ионной связью являются электролитами — проводниками второго рода.
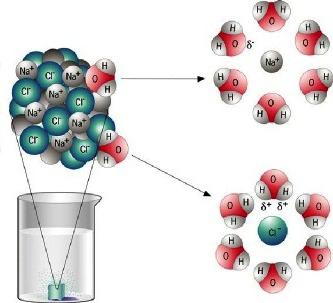
Относятся к группе ионных соединений оксиды и галогениды щелочных и щелочноземельных металлов. Практически все они находят широкое применение в науке, технике, химическом производстве, металлургии.
Похожие статьи
- Ионная связь: примеры соединений
- Химическая связь - понятие и классификация
- Ионы – это заряженные атомы и атомные группы. Понятие об ионных реакциях и заряде ионов
- Виды химических связей. Как соединить атомы?
- Типы кристаллических решеток. Типы кристаллических решеток металлов
- Основные механические свойства твердых тел
- Ковалентная полярная связь: формула, свойства, особенности

