Агрегатное состояние вещества. Изменение агрегатных состояний вещества
Вся материя может существовать в одном из четырех видов. Каждый из них — это определенное агрегатное состояние вещества. В природе Земли только одно представлено сразу в трех из них. Это вода. Ее легко увидеть и испаренную, и расплавленную, и отвердевшую. То есть пар, воду и лед. Ученые научились проводить изменение агрегатных состояний вещества. Самую большую сложность для них составляет только плазма. Для этого состояния нужны особенные условия.

Что это такое, от чего зависит и как характеризуется?
Если тело перешло в другое агрегатное состояние вещества, то это не значит, что появилось что-то другое. Вещество остается прежним. Если у жидкости были молекулы воды, то такие же они будут и у пара со льдом. Изменится только их расположение, скорость движения и силы взаимодействия друг с другом.
При изучении темы «Агрегатные состояния (8 класс)» рассматриваются только три из них. Это жидкость, газ и твердое тело. Их проявления зависят от физических условий окружающей среды. Характеристики этих состояний представлены в таблице.
| Название агрегатного состояния | твердое тело | жидкость | газ |
| Его свойства | сохраняет форму с объемом | имеет постоянный объем, принимает форму сосуда | не имеет постоянных объема и формы |
| Расположение молекул | в узлах кристаллической решетки | беспорядочное | хаотичное |
| Расстояние между ними | сравнимо с размерами молекул | приблизительно равно размерам молекул | существенно больше их размеров |
| Как двигаются молекулы | колеблются около узла решетки | не перемещаются от места равновесия, но иногда совершают большие скачки | беспорядочное с редкими столкновениями |
| Как они взаимодействуют | сильно притягиваются | сильно притягиваются друг к другу | не притягиваются, силы отталкивания проявляются при ударах |
Первое состояние: твердое тело
Его принципиальное отличие от других в том, что молекулы имеют строго определенное место. Когда говорят про твердое агрегатное состояние, то чаще всего имеют в виду кристаллы. В них структура решетки симметричная и строго периодичная. Поэтому она сохраняется всегда, как далеко не распространялось бы тело. Колебательного движения молекул вещества недостаточно для того, чтобы разрушить эту решетку.
Но существуют еще и аморфные тела. В них отсутствует строгая структура в расположении атомов. Они могут быть где угодно. Но это место так же стабильно, как и в кристаллическом теле. Отличие аморфных веществ от кристаллических в том, что у них нет определенной температуры плавления (отвердевания) и им свойственна текучесть. Яркие примеры таких веществ: стекло и пластмасса.
Второе состояние: жидкость
Это агрегатное состояние вещества представляет собой нечто среднее между твердым телом и газом. Поэтому сочетает в себе некоторые свойства от первого и второго. Так, расстояние между частицами и их взаимодействие похоже на то, что было в случае с кристаллами. Но вот расположение и движение ближе к газу. Поэтому и форму жидкость не сохраняет, а растекается по сосуду, в который налита.
Третье состояние: газ
Для науки под названием «физика» агрегатное состояние в виде газа стоит не на последнем месте. Ведь она изучает окружающий мир, а воздух в нем очень распространен.
Особенности этого состояния заключаются в том, что силы взаимодействия между молекулами практически отсутствуют. Этим объясняется их свободное движение. Из-за которого газообразное вещество заполняет весь объем, предоставленный ему. Причем в это состояние можно перевести все, нужно только увеличить температуру на нужную величину.
Четвертое состояние: плазма
Это агрегатное состояние вещества представляет собой газ, который полностью или частично ионизирован. Это значит, что в нем число отрицательно и положительно заряженных частиц практически одинаковое. Возникает такая ситуация при нагревании газа. Тогда происходит резкое ускорение процесса термической ионизации. Оно заключается в том, что молекулы делятся на атомы. Последние потом превращаются в ионы.

В рамках Вселенной такое состояние очень распространено. Потому что в нем находятся все звезды и среда между ними. В границах Земной поверхности оно возникает крайне редко. Если не считать ионосферы и солнечного ветра, плазма возможна только во время грозы. Во вспышках молнии создаются такие условия, в которых газы атмосферы переходят в четвертое состояние вещества.
Но это не означает, что плазму не создали в лаборатории. Первое, что удалось воспроизвести — это газовый разряд. Теперь плазма заполняет лампы дневного света и неоновую рекламу.

Как осуществляется переход между состояниями?
Для этого нужно создать определенные условия: постоянное давление и конкретную температуру. При этом изменение агрегатных состояний вещества сопровождается выделением или поглощением энергии. Причем этот переход не происходит молниеносно, а требует определенных временных затрат. В течение всего этого времени условия должны быть неизменными. Переход происходит при одновременном существовании вещества в двух ипостасях, которые поддерживают тепловое равновесие.
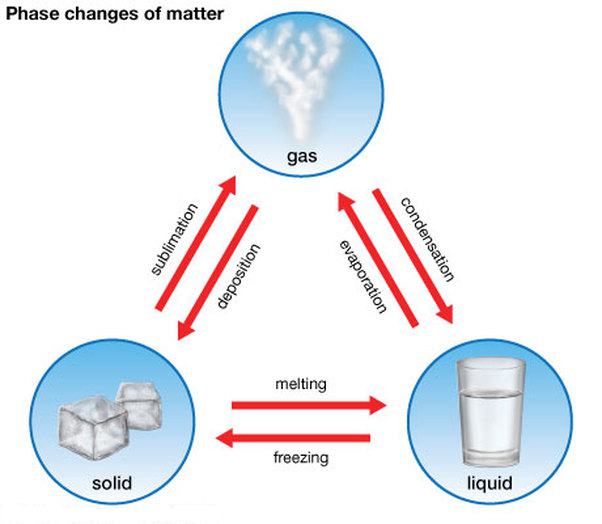
Первые три состояния вещества могут взаимно переходить одно в другое. Существуют прямые процессы и обратные. Они имеют такие названия:
- плавление (из твердого в жидкое) и кристаллизация, например, таяние льда и отвердевание воды;
- парообразование (из жидкого в газообразное) и конденсация, примером является испарение воды и получение ее из пара;
- сублимация (из твердого в газообразное) и десублимация, к примеру, испарение сухого ароматизатора для первого из них и морозные узоры на стекле ко второму.
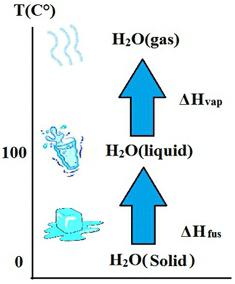
Физика плавления и кристаллизации
Если твердое тело нагревать, то при определенной температуре, называемой температурой плавления конкретного вещества, начнется изменение агрегатного состояния, которое называется плавление. Этот процесс идет с поглощением энергии, которая называется количеством теплоты и обозначается буквой Q. Для ее расчета потребуется знать удельную теплоту плавления, которая обозначается λ. И формула принимает такое выражение:
Q = λ * m, где m — масса вещества, которое задействовано в плавлении.
Если происходит обратный процесс, то есть кристаллизация жидкости, то условия повторяются. Отличие только в том, что энергия выделяется, и в формуле появляется знак «минус».
Физика парообразования и конденсации
При продолжении нагревания вещества, оно постепенно приблизится к температуре, при которой начнется его интенсивное испарение. Этот процесс называется парообразованием. Оно опять же характеризуется поглощением энергии. Только для его вычисления требуется знать удельную теплоту парообразования r. А формула будет такой:
Q = r * m.
Обратный процесс или конденсация происходят с выделением того же количества теплоты. Поэтому в формуле опять появляется минус.
Похожие статьи
- Сернистый газ — физические свойства, получение и применение
- Динамическая и кинематическая вязкость жидкости. Что это такое?
- Основные свойства жидкостей
- Экзотермическая реакция - это процесс, сопровождаемый выделением энергии
- Строение газообразных, жидких и твердых тел кратко
- Географические оболочки Земли: виды и характеристики
- Коллоидные системы: типы, свойства и значение
