Принцип Паули в физике и химии: особенности применения
История атомной физики насчитывает немало взлетов и падений. Но благодаря техническому прогрессу любое предположение, возникшее в умах теоретиков, могло быть проверено в лабораторных условиях. Поскольку многие аспекты поведения элементарных частиц до сих пор не поддаются законами логики, ученые-первооткрыватели микромира договорились принимать их «как есть», без объяснения причин. Принцип Паули относится к результатам тех экспериментов, которые до сих пор не нашли своего единственного объяснения.
Противоречия в теории атома
Одним из самых распространенных успешных заблуждений в атомной физике явилась планетарная атомная модель, предложенная английским ученым Эрнестом Резерфордом. Она в итоге оказалась не совсем достоверной, но дала возможность сделать столько правильных выводов, что польза от нее была несомненной.
Теория Бора
В 1913 году молодой неизвестный физик из Дании предложил включить в классическую физику два изменения, с помощью которых можно было объяснить факты наблюдений и совершить множество полезных открытий. Бор не смог объяснить причину поведения электрона на орбите, поэтому в основу своих правил положил принцип «как есть». Данные правила в дальнейшем сослужили хорошую службу и проложили дорогу к новым открытиям.
Правила Бора

Первое правило гласило, что планетарная модель атома, предложенная Резерфордом, все-таки является верной. Но электроны в ней движутся по своим орбитам без излучения. Второе правило Бора утверждает, что движение электронов возможно лишь по определенным «разрешенным» орбитам. У электрона, совершающего свое движение по разрешенной орбите, произведение импульса на радиус этой орбиты всегда кратно постоянной Планка. Таким образом, орбиты электронов могут находиться лишь на тех энергетических уровнях, для которых выполняется следующее правило:
(импульс электрона * длину окружности орбиты) = n * h,
где h – это постоянная планка, а n – натуральное число. Таким образом, при наименьшей разрешенной орбите n = 1. Третье правило говорит о том, что электроны атомов можно переместить (например, бомбардируя их тяжелыми частицами) на свободную внешнюю орбиту. После этого электрон в состоянии вернуться на свободную внутреннюю орбиту. При этом атом испускает избыток энергии в виде кванта света.
Квантовые ограничения
Квантовое правило Бора предполагает, что электроны, которые находятся на самом близком расстоянии к ядру, имеют наименьшую разрешенную орбиту. На этом уровне электрон обладает минимальной энергией. Можно было бы ожидать, что все электроны в атоме должны были бы занять эту орбиту и оставаться на этом уровне. Однако этого не происходит. Объяснить данное противоречие помог принцип Паули.
Вольфганг Паули
Этот знаменитый австрийский физик родился в Вене в 1869 году. В Мюнхенском университете он получил отличное всестороннее образование, но все свои научные труды посвятил квантовой физике. В двадцатилетнем возрасте Паули пишет обзорную статью для Физической энциклопедии, многие страницы которой и в наше время являются актуальными. Его научные работы редко публиковались, важнейшие свои мысли и гипотезы Паули озвучивал в переписке со своими коллегами по научной деятельности. Наиболее оживленная переписка велась с Н. Бором и В. Гейзенбергом. Именно совместная работа трех этих ученых положила начало основам современной квантовой физики. Основываясь на данных экспериментов этих трех виднейших ученых, свой принцип Паули и сформировал. За него в 1945 году австрийский ученый получил Нобелевскую премию.
Движение электронов
Исследуя движение электрона, В. Паули натолкнулся на множество странных моментов в поведении этой элементарной частицы. Например, электроны при движении ведут себя так, как будто вращаются вокруг своей оси. Собственный момент вращения электрона называется спином. На одном месте на орбите могут уместиться два электрона, при этом спины у них должны быть противоположны друг другу, как утверждает принцип Паули. Физика этого ограничения действует не только для электронов, но и для других частиц с полуцелым значением спина.
Периодическая система и принцип Паули
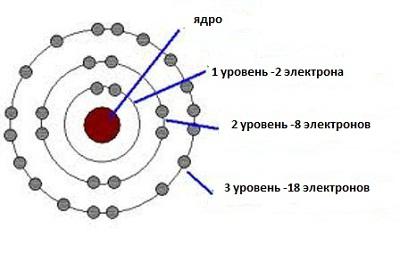
Химия воспользовалась принципом неопределенности для объяснения внутреннего строения веществ. Теперь становится вполне объяснимым, почему в первом ряду таблицы Менделеева находятся лишь два элемента. И водород, и гелий имеют в своем распоряжении единственную нижнюю орбиту, на которой имеется лишь одно сдвоенное место для электронов, имеющих противоположные спины. Следующая орбита вмещает в себя уже восемь таких мест. Поэтому второй ряд периодической системы смогли занять восемь элементов. Данная закономерность простирается на все ряды периодической системы.
Физика звезд
Как ни странно, законы поведения элементарных частиц простираются далеко за пределы микромира. Например, внутренним миром стареющих звезд занимается звездная физика. Принцип Паули работает и здесь, только его понимают немного иначе. Теперь данное правило говорит о том, что в определенном пространственном объеме имеется возможность расположиться лишь двум элементарным частицам с противоположными спинами. Особенно наглядно этот закон действует при наблюдении за стареющими звездами. Как известно, после взрыва сверхновая звезда стремительно коллапсирует, но далеко не все звезды при этом превращаются в черные дыры. При повышении порога предельной плотности (а для стареющей звезды это значение составляет порядка 107 кг/м3) внутреннее давление космического тела начитает стремительно расти. Данный процесс имеет особый научный термин – давление вырожденного электронного газа. Таким образом, звезда прекращает терять свой объем и превращается в небольшое небесное тело размером с нашу Землю. Такие звезды в астрофизике называются белыми карликами.
Итоги
Принцип неопределенности – это один из первых законов нового типа, который отличается от всех известных нам представлений об окружающем мире. Новые законы принципиально отличаются от известных нам с детства правил классической физики. Если старые правила говорили о том, что может произойти при осуществлении тех или иных действий, то законы нового типа указывают нам на то, что происходить не должно.

Алгоритмы решения многих задач стоит строить по слегка видоизмененному принципу Паули. Отсекая в самом начале невозможные варианты решения задач, есть шанс найти единственно верный ответ. Практическое использование принципа неопределенности заметно уменьшает время, необходимое для компьютерной обработки информации. Известный ранее лишь в кругу физиков-теоретиков принцип Паули давно вышел за пределы квантовой физики, тем самым обозначив новые методы изучения законов природы.
Похожие статьи
- Каково распределение электронов по энергетическим уровням у разных химических элементов
- Периодический закон химических элементов Дмитрия Ивановича Менделеева
- Электронная конфигурация атома -схемы и модели
- Генератор свободной энергии с самозапиткой своими руками. Схема генератора свободной энергии
- Хлор: валентность, химические свойства
- Торсионные поля: что мы о них знаем?
- Принцип неопределенности Гейзенберга в квантовой механике
