Что такое соль? Формула, свойства соли (химия)
Для того чтобы ответить на вопрос, что такое соль, обычно долго задумываться не приходится. Это химическое соединение в повседневной жизни встречается достаточно часто. Об обычной поваренной соли и говорить не приходится. Подробное внутреннее строение солей и их соединений изучает неорганическая химия.
Определение соли
Четкий ответ на вопрос, что такое соль, можно найти в трудах М. В. Ломоносова. Такое имя он присвоил хрупким телам, которые могут растворяться в воде и не воспламеняются под воздействием высоких температур или открытого огня. Позднее определение выводили не из их физических, а из химических свойств данных веществ.

Школьные учебники неорганической химии дают достаточно ясное понятие того, что такое соль. Так называются продукты замещения химической реакции, при которой атомы водорода кислоты в соединении замещаются на металл. Примеры типичных соединений солей: NaCL, MgSO4. Легко увидеть, что любую эту запись можно разделить на две половины: в левой составляющей формулы всегда будет записан металл, а в правой – кислотный остаток. Стандартная формула соли выглядит следующим образом:
Men m Кислотный остатокmn.
Физические свойства соли
Химия, как точная наука, вкладывает в название того или иного вещества всю возможную информацию о его составе и возможностях. Так, все наименования солей в современной интерпретации состоят из двух слов: одна часть имеет название металлического составляющего в именительном падеже, вторая - содержит описание кислотного остатка.
Эти соединения не имеют молекулярного строения, поэтому при обычных условиях они представляют собой твердые кристаллические вещества. Многие соли обладают кристаллической решеткой. Кристаллы этих веществ тугоплавки, поэтому для их плавления нужны очень высокие температуры. Например, сульфид бария плавится при температуре около 2200о С.

По растворимости соли делятся на растворимые, малорастворимые и нерастворимые. Примером первых могут служить хлорид натрия, нитрат калия. К малорастворимым относят сульфит магния, хлорид свинца. Нерастворимые – это карбонат кальция. Информация о растворимости того или иного вещества содержится в справочной литературе.
Рассматриваемый продукт химической реакции обычно не имеет запаха и обладает разным вкусом. Предположение о том, что все соли соленые - ошибочно. Чистый соленый вкус имеет только один элемент этого класса – наша старая знакома поваренная соль. Существуют сладкие соли бериллия, горькие – магния и безвкусные – например, карбонат кальция (мел обыкновенный).
Большинство данных веществ бесцветно, но среди них имеются и такие, которые имеют характерные окрасы. Например, железа (II) сульфат отличается характерным зеленым цветом, калия перманганат – фиолетовый, а кристаллы хромата калия – ярко-желтые.

Классификация соли
Химия разделяет все виды неорганических солей на несколько основных признаков. Соли, получающиеся при полном замещении водорода в кислоте, называют нормальными или средними. Например, сульфат кальция.
Соль, которая является производной от реакции неполного замещения, называется кислой или основной. Примером такого образования может быть реакция гидросульфата калия:

Основная соль получается при такой реакции, в которой гидроксогруппа не полностью замещается на кислотный остаток. Вещества данного вида могут быть образованны теми металлами, чья валентность равна двум или больше. Типичная формула соли этой группы может быть выведена из такой реакции:
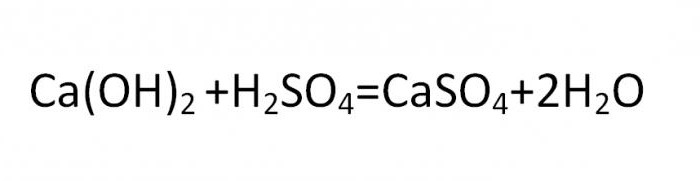
Нормальные, средние и кислые химические соединения образуют классы солей и являются стандартной классификацией этих соединений.
Двойная и смешанная соль
Химия неорганических веществ показывает, что данный продукт может быть образован двумя металлами и одной кислотой. В этом случае кислота должна иметь основность больше или равной 2. Такое соединение называют двойная соль. Химические соли этой группы – алюмокалиевые квасцы, их еще называют сульфат калия-алюминия.
Примером смешанной является кальциевая соль соляной и хлорноватистой кислоты: CaOCl2.
Номенклатура
Соли, образованные металлами с переменной валентностью, имеют дополнительное обозначение: после формулы в скобках пишут римскими цифрами валентность. Так, существует сульфат железа FeSO4 (II) и Fe2 (SO4)3 (III). В названии солей имеется приставка гидро-, если в ее составе существуют незамещенные атомы водорода. Например, гидрофосфат калия обладает формулой K2HPO4 .
Свойства солей в электролитах
Теория электролитической диссоциации дает собственное толкование химическим свойствам. В свете этой теории соль может быть определена как слабый электролит, который в растворенном виде диссоциирует (распадается) в воде. Таким образом, раствор соли можно представить как комплекс положительных отрицательных ионов, причем первые – это не атомы водорода Н+, а вторые – не атомы гидроксогруппы ОН-. Ионов, которые присутствовали бы во всех видах растворов солей, не существует, поэтому какими-либо общими свойствами они не обладают. Чем меньше заряды ионов, образующих раствор соли, тем лучше они диссоциируют, тем лучше электропроводимость такой жидкой смеси.
Растворы кислых солей
Кислые соли в растворе распадаются на сложные отрицательные ионы, представляющие собой кислотный остаток, и простые анионы, являющиеся положительно заряженными частицами металла.

Полная формула выглядит таким образом: NaHCO3 = Na+ + HCO3-, HCO3 - = H+ + CO32-.
Растворы основных солей
Диссоциация основных солей ведет к образованию анионов кислоты и сложных катионов, состоящих из металлов и гидроксокрупп. Эти сложные катионы, в свою очередь, также способны распадаться в процессе диссоциации. Поэтому в любом растворе соли основной группы присутствуют ионы ОН- . Например, диссоциация хлорида гидроксомагния протекает следующим образом:
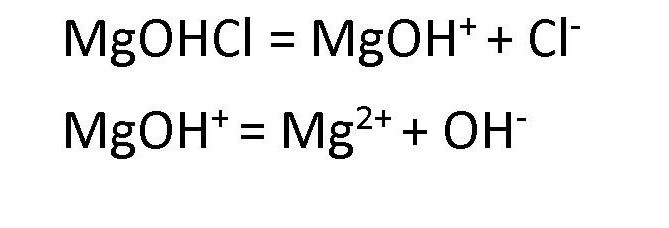
Распространение солей
Что такое соль? Этот элемент является одним из самых распространенных химических соединений. Всем известны поваренная соль, мел (карбонат кальция) и прочее. Среди солей карбонатной кислоты самым распространенным является карбонат кальция. Он является составной частью мрамора, известняка, доломита. А еще карбонат кальция — основа для формирования жемчуга и кораллов. Это химическое соединение является неотъемлемой составляющей для формирования твердых покровов у насекомых и скелетов у хордовых животных.
Поваренная соль известна нам с детства. Врачи предостерегают от ее чрезмерного употребления, но в умеренных количествах она крайне необходима для осуществления жизненных процессов в организме. А нужна она для поддержания правильного состава крови и вырабатывания желудочного сока. Физрастворы, неотъемлемая часть инъекций и капельниц, есть не что иное, как раствор поваренной соли.
Похожие статьи
- Английская соль (эпсома): лечебные свойства, применение и особенности
- Кошерная соль и её особенности
- Йодированная соль: полезные свойства и противопоказания
- Чем заменить соль в питании?
- Гималайская соль для бани: полезные свойства, применение, отзывы
- Нитраты - это что такое? Реакции нитратов. Растворы нитратов
- Морская соль для волос - средство, дарящее густоту и силу. Отзывы об эффективности морской соли для волос
