Энтальпия - это что такое?
Что собой представляет энтальпия образования веществ? Как использовать эту величину в термохимии? Для того чтобы найти ответы на эти вопросы, рассмотрим основные термины, связанные с тепловым эффектом протекания химического взаимодействия.
Тепловой эффект реакции
Это величина, которая характеризует количество теплоты, выделяемой либо поглощаемой во время взаимодействия веществ.
Если процесс осуществляется при стандартных условиях, тепловой эффект называется стандартным эффектом реакции. Это и есть стандартная энтальпия образования продуктов реакции.
Теплоемкость процесса
Это физическая величина, которая определяет отношение небольшого количества теплоты к изменению температуры. В качестве единиц измерения теплоемкости используют Дж/К.
Удельной теплоемкостью называют то количество тепловой энергии, которое необходимо для увеличения температуры на градус по шкале Цельсия для тела, имеющего массу один килограмм.
Термохимический эффект
Практически для любой химической реакции можно вычислить количество энергии, которое поглощается либо выделяется при взаимодействии химических компонентов.
Экзотермическими называют такие превращения, в результате которых в атмосферу выделяется некоторое количество теплоты. Например, положительным эффектом характеризуются процессы соединения.
Энтальпия реакции вычисляется с учетом состава вещества, а также стереохимических коэффициентов. Эндотермические взаимодействия предполагают поглощение некоторого количества тепла для того, чтобы началась химическая реакция.
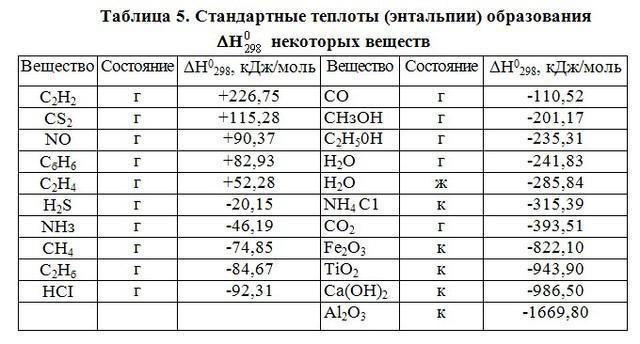
Стандартная энтальпия является величиной, используемой в термохимии.
Самопроизвольное протекание процесса
В термодинамической системе самопроизвольно протекает процесс в том случае, когда происходит уменьшение свободной энергии взаимодействующей системы. В качестве условия достижения термодинамического равновесия рассматривается минимальная величина термодинамического потенциала.
Только при условии сохранения во времени постоянных внешних условий, можно вести речь о неизменности взаимодействия.
Один из разделов термодинамики изучает именно равновесные состояния, в которых энтальпия - это величина, рассчитываемая для каждого отдельного процесса.
Химические процессы являются обратимыми в тех случаях, когда они протекают сразу в двух взаимно реверсных направлениях: обратном и прямом. Если в закрытой системе наблюдается обратный процесс, в таком случае через определенный временной промежуток система достигнет равновесного состояния. Оно характеризуется прекращением изменения концентрации всех веществ во времени. Такое состояние не означает полного прекращения реакции между исходными веществами, поскольку равновесие является динамическим процессом.
Энтальпия - это физическая величина, которую можно вычислить для разных химических веществ. Количественной характеристикой равновесного процесса является константа равновесия, выражаемая через парциальные давления, равновесные концентрации, мольные доли взаимодействующих веществ.
Для любого обратимого процесса можно вычислить константу равновесия. Она зависит от температуры, а также от природы взаимодействующих компонентов.
Рассмотрим пример возникновения в системе состояния равновесия. В начальный момент времени в системе есть только исходные вещества А и В. Скорость прямой реакции имеет максимальную величину, а обратный процесс не протекает. По мере снижения концентрации исходных компонентов наблюдается увеличение скорости обратного процесса.
Учитывая, что энтальпия - это физическая величина, которую можно рассчитать для реагирующих веществ, а также для продуктов процесса, можно сделать определенные выводы.
Спустя определенный временной промежуток, скорость прямого процесса равна скорости обратного взаимодействия. Константа равновесия представляет собой отношение констант скорости прямого и обратного процесса. Физический смысл этой величины показывает, во сколько раз скорость прямого процесса превышает величину обратного взаимодействия при определенной концентрации и температуре.

Воздействие внешних факторов на кинетику процесса
Поскольку энтальпия - это величина, которая используется для термодинамических расчетов, существует связь между ней и условиями протекания процесса. Например, на термодинамическое взаимодействие влияет концентрация, давление, температура. При изменении одной из этих величин, происходит смещение равновесия.

Энтальпия представляет собой термодинамический потенциал, который характеризует состояние системы в равновесии при выборе в виде независимых переменных энтропии, давления, количества частиц.
Энтальпия характеризует уровень энергии, который сохраняется в его молекулярной структуре. Следовательно, если вещество обладает энергией, она не в полном объеме преобразуется в теплоту. Часть ее сохраняется непосредственно в веществе, она необходима для функционирования вещества при определенном давлении и температуре.

Заключение
Изменение энтальпии является мерой теплоты химической реакции. Она характеризует то количество энергии, которое необходимо для теплообмена при неизменном давлении. Этой величиной пользуются в тех ситуациях, когда неизменными величинами в процессе будут давление и температура.
Энтальпию часто характеризуют в виде полной энергии вещества, поскольку она определяется как сумма внутренней энергии и работы, которую совершает система.
В реальности эта величина выступает в качестве общего количества энергии, которое характеризует энергетические показатели вещества, преобразующиеся в теплоту.
Данный термин был предложен Х. Камерлинг-Оннесом. При проведении термодинамических расчетов в неорганической химии, должно быть учтено количество вещества. Расчеты проводят при температуре, соответствующей 298 К, давлении 101 кПа.
Закон Гесса, являющийся основным параметром для современной термохимии, позволяет определять возможность самопроизвольного протекания химического процесса, вычислять его тепловой эффект.
Похожие статьи
- Энергия Гиббса и ее использование для описания возможности протекания процессов
- Первое начало термодинамики -объяснение этого закона и практические примеры.
- Теплоемкость воды и пара. Определение и применение
- Количество теплоты: понятие, расчеты, применение
- Карбид алюминия: сферы применения вещества
- Адиабатный процесс, его суть и и формулы
- Второй закон термодинамики. Трактовки, теоретическое и практическое обоснование
