Первое начало термодинамики -объяснение этого закона и практические примеры.
Такие физические процессы, как теплота и работа, можно объяснить простой передачи энергии от одного тела к другому. В случае с работой речь идет о механической энергии, теплота же предполагает энергию термическую. Передача энергии ведется по законам термодинамики. Главные положения этого раздела физики известны как «начала».
Первое начало термодинамики регулирует и ограничивает процесс передачи энергии в той или иной системе.
Виды энергетических систем
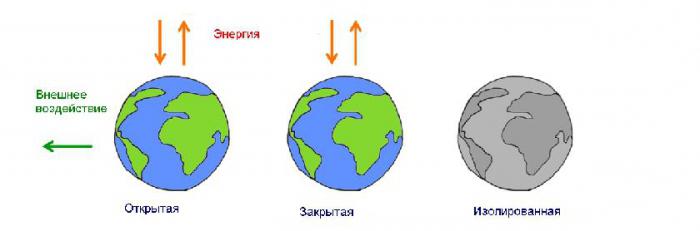
В физическом мире существует два типа энергетических систем. Замкнутая, или закрытая система имеет постоянную массу. В открытой, или незамкнутой системе масса может уменьшаться и увеличиваться в зависимости от процессов, протекающих в этой системе. Большинство наблюдаемых систем являются незамкнутыми.
Энергия изолированной системы
Любая замкнутая система, в которой отсутствует обмен энергией с окружающей средой, является изолированной. Равновесное состояние такой системы определяется показаниями таких величин:
- P– давление в системе;
- V – объем изолированной системы
- T– температура;
- n – число молей газа в системе;
как видно, количество тепла и выполненная работа не входят в этот перечень. Закрытая изолированная система не совершает теплообмен и не производит работу. Ее полная энергия остается неизменной.
Изменение энергии системы
При совершении работы или возникновении процесса теплообмена состояние системы изменяется, и изолированной она уже считаться не будет.
Формулировка первого начала термодинамики
Внутренняя энергия замкнутой системы состоит из суммы энергий всех частиц этой системы. Изменить эту энергию можно, только воздействуя на систему извне. Внутренняя энергия такой замкнутой системы будет увеличиваться либо из-за работы, которая была совершена над системой, или же из-за передачи такой системе определенного количества теплоты. Уменьшение полной энергии системы будет также зависеть от двух факторов – либо она отдаст тепло, либо совершит какую-либо работу.
Изменение количества полной энергии можно выразить формулой, которая будет выглядеть так:

Если речь идет о работе, совершенной над системой, то переменная W будет иметь отрицательную величину. Это формула и представляет собой первое начало термодинамики.
Закон сохранения
Этот закон по праву считается одним из фундаментальных законов физики. Теплота и работа являются основными способами передачи энергии, и изменение внутренней энергии системы напрямую зависит от этих величин. Таким образом, первый закон термодинамики является видоизмененным законом сохранения энергии.
Прежде всего первое начало термодинамики было выведено для изолированных систем. Позднее было доказано, что закон универсален, и его можно применять к незамкнутым системам, если правильно учитывать изменение внутренней энергии, происходящее из-за колебания количества вещества в системе. Если рассматриваемая система переходит из состояния А в состояние Б, то работа, совершенная системой W, и количество теплоты Q будут различаться. Различные процессы дают неодинаковые показания этих переменных даже в случае, если в конечном итоге система придет в первоначальное состояние. Но при этом разница W-Q будет всегда одна и та же. Иными словами, если после какого-либо воздействия система пришла в первоначальное состояние, то независимо от типа процессов, учувствовавших в преобразовании такой системы, соблюдается правило W-Q= const.
В некоторых случаях удобнее использовать дифференциальную формулу выражения первого закона. Он выглядит так:dU=dW-dQ
здесь dU - бесконечно малое изменение внутренней энергии
dW- величина, характеризующая бесконечно малую работу системы
dQ- бесконечно малое количество теплоты, переданное данной системе.
Энтальпия
Для более широкого применения первого закона термодинамики вводится понятие энтальпии.
Так называется общее количество полной энергии вещества и произведения объема и давления. Физическое выражение энтальпии можно представить такой формулой:
H = U + pV
Абсолютное значение энтальпии представляет собой сумму энтальпий всех частей, из которых состоит система.
В количественном выражении эта величина не может быть определена. Физики оперируют лишь разностью энтальпий конечного и начального состояния системы. Ведь при любых расчетах изменения состояния системы выбирают определенный уровень, при котором потенциальная энергия равна нулю. Точно также поступают и при расчете энтальпии. Если применить понятие энтальпии, то первое начало термодинамики для изопроцессов будет выглядеть таким образом:dU=dW-dH
Энтальпия любой системы зависит от внутреннего строения веществ, которые составляют эту систему. Эти показатели, в свою очередь, зависят от строения вещества, его температуры, количества и давления. Для сложных веществ можно вычислить стандартную энтальпию образования, которая равна тому количеству теплоты, которое понадобится для образования моля вещества из простых составляющих. Как правило, величина стандартной энтальпии отрицательная, так как при синтезе сложных веществ в большинстве случаев выделяется теплота.
Первый закон термодинамики в адиабатических процессах
Применение первого начала термодинамики для изопроцессов можно рассмотреть графически. К примеру, рассмотрим адиабатический процесс, в котором количество теплоты в течение всего времени остается неизменным, то есть Q=const. Такой изопроцесс протекает в теплоизолированных системах, или за столь короткое время, что система не успевает совершить теплообмен с внешней средой. Медленное расширение газа на диаграмме "объем-давление" описывается такой кривой:
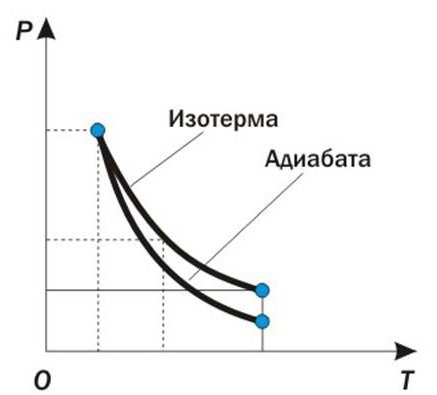
По графику можно обосновать применение первого начала термодинамики к изопроцессам. Поскольку изменения количества теплоты в адиабатическом процессе не происходит, изменение внутренней энергии равно количеству произведенной работы. dU=- dW
Отсюда следует, что внутренняя энергия системы убывает, и температура ее падает.
Примеры адиабатических процессов
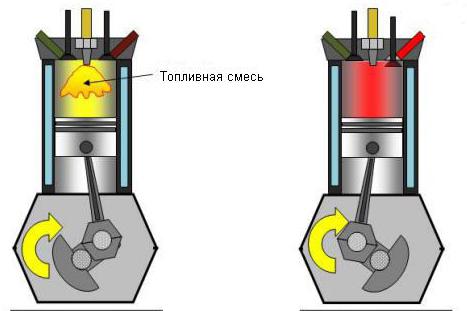
Верно и обратное утверждение: понижение давления при отсутствии теплообмена резко повышает температуру системы. Приблизительно так расширяется газ в двигателях внутреннего сгорания. В двигателях Дизеля горючий газ сжимается в 15 раз. Кратковременное повышение температуры позволяет горючей смеси самостоятельно воспламениться.
Можно рассмотреть еще один пример адиабатического процесса – свободное расширение газов. Для этого рассмотрим такую установку, состоящую из двух емкостей:
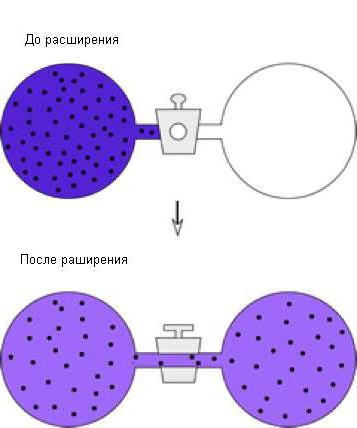
В первой емкости имеется газ, во второй он отсутствует. Поворачивая кран, мы добьемся того, что газ заполнит весь отведенный ему объем. При достаточной изолированности системы температура газа останется неизменной. Поскольку газ не выполнял никакой работы, переменная dW=const. Выяснилось, что при прочих равных условиях температура газа при расширении понижается. Расширение газа происходит неравномерно, поэтому на диаграмме "давление-объем" этот процесс представлен быть не может.
Первое начало термодинамики является универсальным законом, применяющимся во всех обозримых процессах Вселенной. Глубокое понимание причин тех или иных превращений энергии позволяет понимать существующие физические явления и открывать новые законы.
