Комплексные соединения и их значение
Комплексные соединения (КС) играют важную роль в деятельности живых организмов. Они также широко применяются в промышленности. Сегодня мы рассмотрим их видовое разнообразие, применение и историю исследования.
Введение в комплексные соединения
Комплексные соединения – это вещества, образующиеся при соединении лиганда и комплексообразователя. Играть роль взаимодействующих частичек могут атомы и ионы. А. Вернер в 1893-м представил миру теорию комплексных соединений, также называемую координационной теорией.
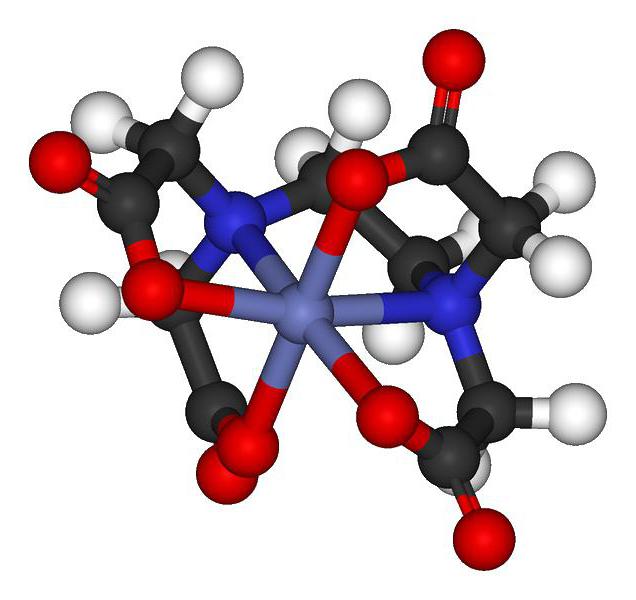
Для КС характерны наличие внешней сферы и полная диссоциация в растворе воды на малодиссоциирующие катионы и анионы. Однако есть и такие виды, у которых отсутствует внешняя сфера, что не позволяет им растворяться в воде. Существует огромное количество КС.
Виды соединений
Комплексные соединения разделяются на три главных вида:
- К первому виду, различающемуся по комплексному заряду, относятся комплексы катионного типа, в которых, окружив положительный ион, координируются нейтральные молекулы. Вторым видом называют анионный комплекс, в котором положительно окисленный атом выступает в роли комплексообразователя, а анионы простого или сложного типа составляют лиганды. Третий вид именуют нейтральным комплексом, он образовался из-за молекулярной координации вокруг атома, имеющего нейтральный заряд.
- В зависимости от природы лиганда их разделяют на аммиакаты (аммиак – лиганд), аквакомплексы (лиганд – вода), гидроксокомплексы (лиганды – гидроксид-ионы), ацидокомплексы (лиганды – остатки кислот), карбонилы (лиганды – молекулы углеродных оксидов второй валентности).
- В соответствии с местом расположения лиганды бывают монодентантные, бидентантные и полидентантные КС.
Исторические сведения
В 1893-м была совершена первая попытка исчерпывающе описать структуру КС при помощи координационной теории Альфреда Вернера. Работа была сделана до появления теории электронной валентности, а при исследованиях использовались обычные реакции химической природы.

В своей теории Вернер утверждал, что соединения неорганической природы имеют ядра, составленные из атомов комплексообразующего типа. Атомы, окружающие комплексообразующие, называют координационными. Они располагаются в соответствии с формой простого полиэдра. А. Вернер предполагал наличие связи координационного типа у общей электронной пары, которую атомы либо молекулы будут отдавать другой паре. Однако отсутствие существования подобных соединений вызвало недоверие у сообщества химиков. Вследствие этого следующие два десятилетия ученый пытался создать необходимые вещества, которые бы подтвердили его теорию.
Вернер в 1911-м осуществил синтез свыше сорока молекул оптического типа, которые не содержали углеродные атомы, что в конце концов изменило мнение ученых-химиков о его теории.
Альфред Вернер был удостоен в 1913-м Нобелевской премии за достижения в области химии.
Номенклатура
Комплексные соединения имеют систему создания собственных названий, состоящую из пяти пунктов:
- Первым произносят анион, далее катион.
- Комплексная часть начинается с лиганда – аниона, находящегося во внутренней сфере, и к окончанию его добавляют «о».
- Монодентатные лиганды обозначают при помощи греческих: моно, ди, три, тетра, пента, гекса (1, 2, 3, 4, 5, 6). При работе с полидентатными лигандами используют трис -, бис-, тетракис- и другие.
- Обозначив внутреннюю сферу с ее компонентами, переходят к внешней.
- Комплексообразователь частиц, имеющих нейтральный комплекс, указывается в именительном падеже.
Сведения о структуре
Комплексные соединения располагают внутренней сферой, состоящей из какого-либо числа ионов или молекул нейтральной природы, прочно соединенных с комплексообразователем. Они именуются лигандами. Внутрення сфера может носить заряд трех типов: «+», «-» или «0».
Внешняя координационная сфера представляет собой ионы, которые не разместились в пространстве внутренней сферы.
Связь между лигандом и центральным ионом может обуславливаться либо электростатическим притяжением, либо донорно-акцепторным механизмом.
Изомерия в координационных соединениях является главным статистическим аспектом. Говоря об изомерии, имеют в виду различное взаиморасположение в пространстве атомов либо составных элементов соединения, которое будет влечь за собой изменение физических и химических свойств соответствующего соединения – изомера. Изомерия КС бывает структурной, оптической и пространственной.
Стереохимия
Комплексные соединения, наряду с органическими веществами, высокомолекулярные соединения синтетического или природного происхождения – это главные объекты стереохимических исследований. А. Вернер по праву считается одним из тех ученых, кто дал развитие целой области исследований и оживил некоторые сферы химической деятельности. Стереохимия по сей день остается ориентиром координационных химических исследований.
Некоторые свойства и способы получения
Получение комплексных соединений имеет довольно широкий спектр выбора, однако чаще используются такие:
- Растворение в водном аммиаке гидроксидов, которые не растворяются в воде.
- Взаимодействие аммиака с солями металлов, имеющих комплексообразовательные свойства; чаще это металлы, находящиеся в побочной подгруппе.
- Взаимодействие цианидов или роданидов с металлами или солями.
- Помещение нерастворимых в H2O металлов амфотерного типа, а именно их оксидов или гидроксидов в щелочном растворе.
- Комплексные кислоты могут получать, например, путем взаимодействия золота и «царской водки», или гидроксида Au с HCl.
Множество качественных характеристик соединений зависит от их электронных свойств, так, окрас КС может определяться комплексообразователем и лигандами. Энергетическое расщепление на d-орбитали позволяет «перебираться» электронам с его подуровней dxz, dxy, dzy на подуровни, имеющие более высокий энергетический показатель dz2 или dz2-y2. Это явление сопутствует поглощению световых квантов. Величина разности между расщепленными уровнями обуславливает поглощение световых квантов с волновым диапазоном разной длины, что придает определенный окрас.
Комплексные соединения имеют также два важных магнитных свойства, по которым их классифицируют как парамагнитные и диамагнитные. Парамагнитные комплексы имеют собственные µ-моменты, и по этой причине, попадая во внешние электромагнитные поля, в процессе взаимодействия они втягиваются в них. Диамагнитный комплекс не имеет магнитного момента, и потому магнитное поле спешит вытолкнуть его. Свойства парамагнитного характера обуславливаются присутствием электронов, не имеющих пары, в своей структуре.
Использование

Соединения комплексного типа играют одну из важнейших ролей в любом организме, например, кислород в паре с кровяным гемоглобином доставляют O2 по организму к тканям и клеткам; находящийся внутри растений хлорофилл также считается комплексом.
Применение комплексных соединений широко используется в промышленности. При помощи химических методов, влекущих за собой образование КС, извлекают металлы из руды. Примерами могут служить чистое железо, никель и кобальт, которые получают при помощи температурного разложения карбонилов металлов. Эти сложные вещества, разлагаясь, выделяют необходимые металлы.

Аналитическая химия может использовать КС в качестве индикаторов. Органический и неорганический синтез может ускоряться из-за них, так как им присущи свойства катализатора в силу их высокой активности. Гальванопластика также не может обойтись без комплексных соединений, что обусловливается невозможностью получения столь надежных покрытий из простой соли, в отличие от соединений цианидов.
Похожие статьи
- Азотные удобрения и их применение. Виды азотных удобрений
- Индекс атерогенности: норма и отклонения, причины повышения и лечение
- Химические свойства цинка и его соединений
- Эффективные препараты железа при анемии
- Карбонат аммония: получение, химические свойства, спектр применения
- "Дексаметазон": отзывы. "Дексаметазон": показания к применению и инструкция
- Кремний и его соединения: формулы
