Ацетилен: химические свойства, получение, применение, меры предосторожности

Ацетилен (или по международной номенклатуре - этин) - это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена - C2H2. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Получение
Все методы промышленного получения ацетилена сходятся к двум типам: гидролиз карбида кальция и пиролиз различных углеводородов. Последний требует меньших энергозатрат, но чистота продукта довольно низкая. У карбидного метода - наоборот.
Суть пиролиза заключается в том, что метан, этан или другой легкий углеводород при нагреве до высоких температур (от 1000 °C) превращается в ацетилен с выделением водорода. Нагрев может осуществятся электрическим разрядом, плазмой или сжиганием части сырья. Но проблема состоит в том, что в результате реакции пиролиза может образовываться не только ацетилен, но и еще множество разных продуктов, от которых необходимо впоследствии избавляться.
2CH4 → C2H2 + 3H2
Карбидный метод основан на реакции взаимодействия карбида кальция с водой. Карбид кальция получают из его оксида, сплавляя с коксом в электропечах. Отсюда и такой высокий расход энергии. Зато чистота ацетилена, получаемого таким способом, крайне высока (99,9 %).
CaC2 + H2O → C2H2 + Ca(OH)2
В лаборатории ацетилен также можно получить дегидрогалогенированием дигалогенпроизводных алканов с помощью спиртового раствора щелочи.
CH2Cl-CH2Cl + 2KOH → C2H2 + 2KCl + 2H2O
Физические свойства ацетилена
Ацетилен - это газ без цвета и запаха. Хотя примеси могут давать ему чесночный запах. Практически не растворим в воде, немного растворим в ацетоне. При температуре -83,8 °C сжижается.
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
Реакции присоединения:
- Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.
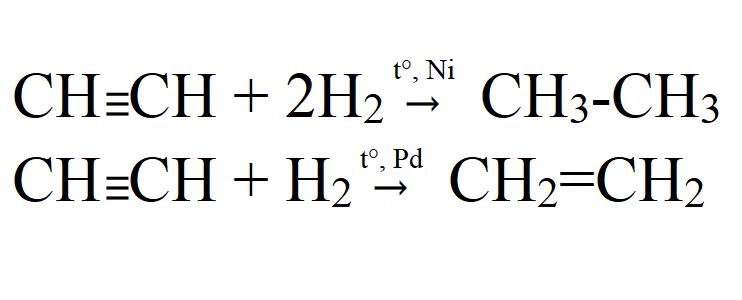
- Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.
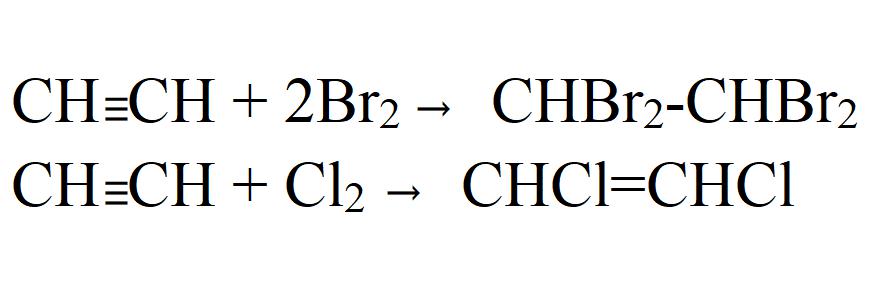
- Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.
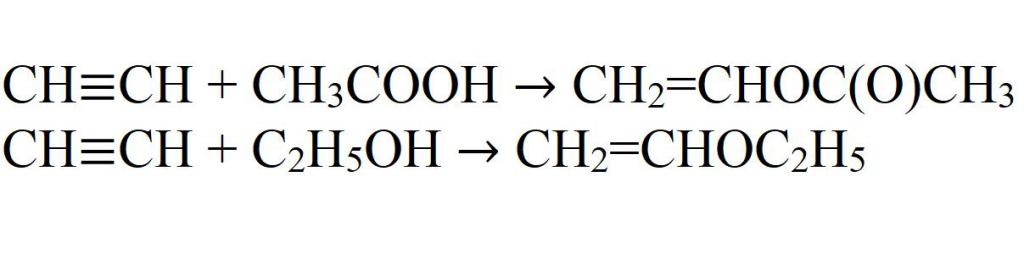
- Присоединение синильной кислоты.
CH≡CH + HCN → CH2=CH-CN
Реакции замещения:
- Взаимодействие ацетилена с металл-органическими соединениями.
CH≡CH + 2C2H5MgBr → 2C2H6 + BrMgC≡CMgBr
- Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + H2
- Взаимодействие с комплексными солями меди и серебра.
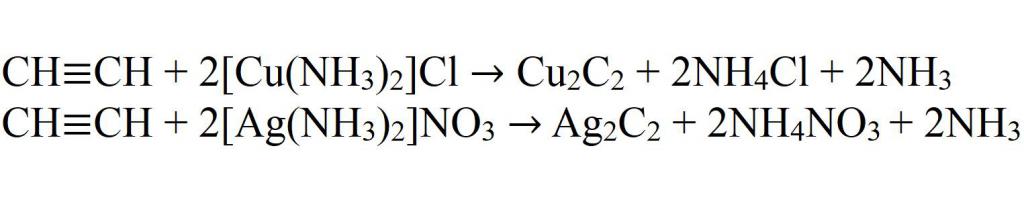
- Взаимодействие с амидом натрия.
CH≡CH + 2NaNH2 → NaC≡CNa + 2NH3
Реакции полимеризации:
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор - соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл - циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.
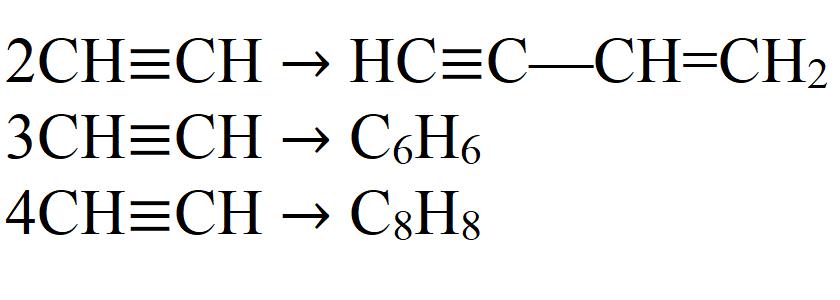
Это далеко не все химические свойства ацетилена.
Применение
Структурная формула ацетилена указывает нам на довольно прочную связь между атомами углерода. При ее разрыве, например при горении, выделяется очень много энергии. По этой причине ацетиленовое пламя обладает рекордно высокой температурой - около 4000 °C. Его используют в горелках для сварки и резки металла, а также в ракетных двигателях.
Пламя горения ацетилена имеет также очень высокую яркость, поэтому его часто используют в осветительных приборах. Используется он и во взрывотехнике. Правда, там применяется не сам ацетилен, а его соли.
Как видно из разнообразных химический свойств, ацетилен может применяться как сырье для синтеза других важных веществ: растворителей, лаков, полимеров, синтетических волокон, пластмасс, органического стекла, взрывчатых веществ и уксусной кислоты.
Безопасность
Как уже говорилось, ацетилен - огнеопасное вещество. С кислородом или воздухом он способен образовывать крайне легковоспламеняющиеся смеси. Чтобы вызвать взрыв, достаточно одной искры от статического электричества, нагрева до 500 °C или небольшого давления. При температуре 335 °C чистый ацетилен самовоспламеняется.
Из-за этого ацетилен хранят в баллонах под давлением, которые наполнены пористым веществом (пемза, активированный уголь, асбест). Таким образом, ацетилен распределяется по порам, уменьшая риск взрыва. Часто эти поры пропитывают ацетоном, из-за чего образуется раствор ацетилена. Иногда ацетилен разбавляют другими, более инертными газами (азот, метан, пропан).
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
Похожие статьи
- Химические свойства этилена. Формула этилена
- Химические свойства алкадиенов - непредельных углеводородов
- Что такое бром? Химический элемент бром: формула, свойства
- Карбид кальция: свойства и применение. Получение ацетилена
- Алканы: общие сведения. Физические и химические свойства алканов
- Физические и химические свойства углерода
- Карбид алюминия: сферы применения вещества
