Изотермический процесс в идеальном газе: формула и график. Изобарно-изотермический процесс

Исследованием изотермических процессов в веществах занимается термодинамика. В качестве мощного инструмента для изучения переходов между разными состояниями системы этот раздел физики использует модель идеального газа. В данной статье рассмотрим, что представляет собой изотермический процесс.
Идеальный газ
Прежде чем переходить непосредственно к раскрытию темы статьи, для более глубокого понимания следует дать характеристику модели этого вещества. Идеальный газ представляет собой систему как совокупность хаотически перемещающихся атомов и молекул. Скорости движения частиц настолько велики, что их кинетическая энергия на несколько порядков превышает потенциальную, которой обладают слабые ван-дер-ваальсовые взаимодействия, что позволяет не учитывать их при выполнении математических расчетов.
Другой особенностью идеальных газов, которая отличает их от реальных систем, является отсутствие у частиц линейных размеров. Конечно же, в действительности они не равны нулю, однако, настолько малы по сравнению с расстояниями средними между молекулами, что их также можно не учитывать.
В идеальном газе существует только один единственный тип взаимодействий - это столкновения упругих безразмерных частиц с твердыми стенками сосуда. Результатом этого является существование в системе некоторого конечного давления.
О каком процессе пойдет речь?
Изотермический процесс - это такой переход из одного в другое термодинамическое состояние системы, при котором параметр температуры остается неизменным. При этом варьируются другие параметры, например, давление, объем, внутренняя энергия. Система может совершать работу или изменять свое агрегатное состояние.

Здесь бы хотелось отметить, что такой переход характерен также для структур, в которых происходит смена агрегатного состояния, например, процессы плавления, кристаллизации, кипения и конденсации являются изотермическими. В их результате система активно обменивается теплом с окружающей средой, а ней самой происходят глобальные перестройки на микроуровне, например, образуется кристаллическая решетка из хаотичного расположения молекул и атомов, но температура при этом сохраняется. Яркий пример - таяние льда при 0 oC.
Закон Бойля-Мариотта
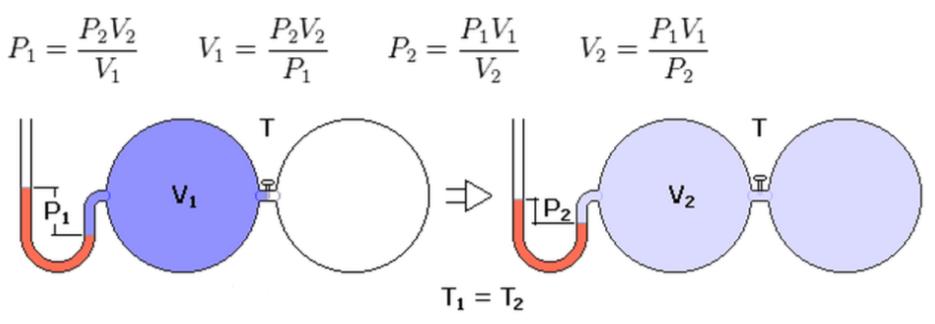
Именно так описывается изотермический процесс в идеальном газе. В конце XVII века, проводя эксперименты с закрытыми системами, Роберт Бойль и Эдм Мариотт установили следующее соотношение между давлением и объемом:
P*V = const при T = const.
Условие постоянства температуры является ключевым для того, чтобы давление и объем были точно обратно пропорциональны друг другу.
Закон Бойля-Мариотта может быть получен из уравнения Клапейрона-Менделеева, которое имеет вид:
P*V = n*R*T.
Здесь n и R - количество вещества и константа для газов соответственно. Видно, что приняв абсолютную температуру за постоянную величину в закрытой системе (n=const), правая часть равенства останется неизменной во время перехода между состояниями.
График изотермического процесса - это кривая функции P(V). Несложно увидеть, что он представляет собой гиперболическую зависимость. Сам график называется изотермой. Чем выше температура T в системе, тем дальше от осей объема и давления будет проходить линия.
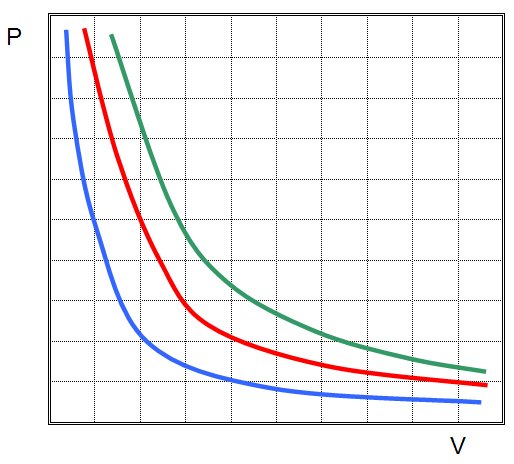
На рисунке выше приведены три изотермы. Структуре с наибольшей абсолютной температурой соответствует зеленая кривая. В то же время, синяя линия описывает поведение системы с наименьшей среди трех температурой.
Изобарно-изотермический процесс
В рамках темы статьи полезно также упомянуть о термодинамическом переходе системы, при котором не изменяется не только температура, но и давление.
Если обратиться к уравнению Клапейрона-Менделеева, которое было выше записано, то можно увидеть в нем четыре переменные величины. Поскольку две из них в рассматриваемом случае являются фиксированными, то можно изменять объем V и количество вещества n. Из указанного уравнения следует закон:
n/V = const при T, P = const.
Записанное соотношение содержит очень важный вывод. Оказывается, при одних и тех же условиях химически разные газы, взятые в равных количествах, будут занимать равные объемы. Например, 1 моль воздуха при одной атмосфере и 0 oC займет точно такой же объем, как 1 моль природного газа или как 1 моль гелия. Этот объем равен 22,4 литра.
Этот закон был получен экспериментально Амедео Авогадро в 1810 году, поэтому сейчас носит его фамилию.
Похожие статьи
- Белоруссия или Беларусь: как правильно говорить и писать?
- Общая характеристика русской литературы 19 века: описание, особенности и интересные факты
- Информатика – это наука... Что изучает информатика?
- Речь: классификация речи, виды и стили речи. Устная и письменная речь
- Как узнать свое тотемное животное по дате рождения
- Женские интимные прически: фото, виды и технология выполнения
- Пунктуационный разбор предложения: легко и просто
