Электронное строение атома кальция

Погружаемся в удивительный мир атомов, где крошечные частицы определяют свойства веществ вокруг нас. Сегодня мы заглянем внутрь атома химического элемента кальция, который играет важную роль в нашей жизни. Узнаем, как устроен этот атом, откроем секреты его строения и поймем, как это влияет на свойства самого кальция и его соединений.
I. Общая характеристика кальция
Кальций - химический элемент с атомным номером 20. Он расположен во второй группе и четвертом периоде таблицы Менделеева. Кальций относится к щелочноземельным металлам, обладает высокой химической активностью.
Впервые металлический кальций был выделен в 1808 году английским химиком Гемфри Дэви методом электролиза. Из-за реакционной способности соединений кальция со щелочами Дэви дал элементу название от латинского "калькс" - известь.
В чистом виде кальций представляет собой мягкий серебристо-белый металл. Он имеет температуру плавления 842°С, тверже натрия и калия. На воздухе кальций быстро покрывается пленкой оксида, поэтому его хранят под слоем керосина или парафина.
В земной коре содержится около 4,5% кальция по массе. Он входит в состав многих горных пород и минералов, важнейшие из них - известняк, мрамор, мел, гипс, доломит, флюорит, апатит.
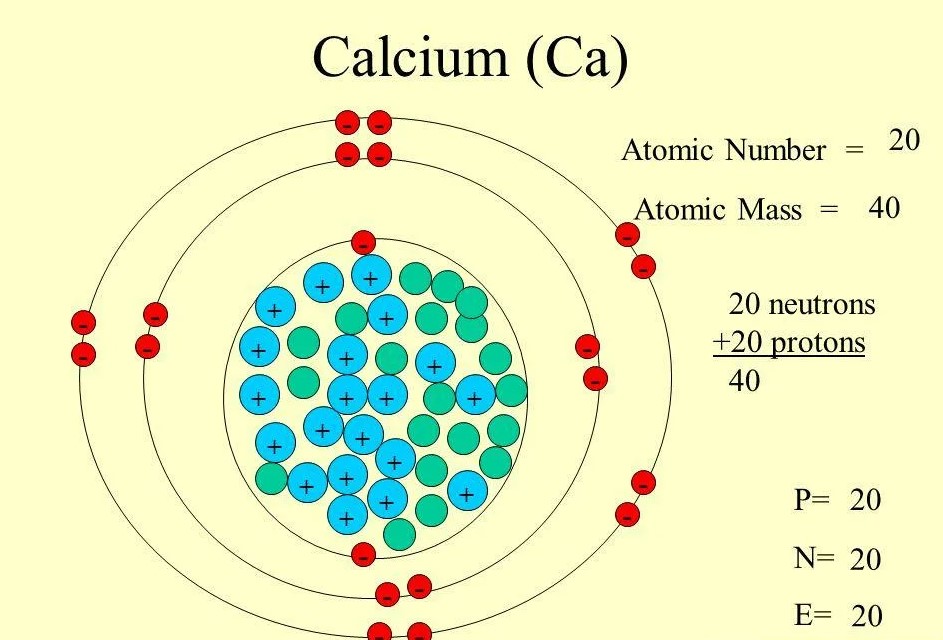
II. Строения атома кальция под микроскопом науки
Давайте рассмотрим, как устроен атом этого удивительного химического элемента. Атом кальция состоит из:20Ca - положительно заряженного ядра, содержащего 20 протонов и 20 нейтронов, и 20 электронов, движущихся по четырем электронным оболочкам вокруг ядра.
Электронная конфигурация атома кальция выглядит так:
1s2 2s2 2p6 3s2 3p6 4s2
Здесь видно, что внешний энергетический уровень содержит два электрона. Это определяет важнейшее свойство кальция - его валентность, равную II. При образовании химических связей кальций отдает эти два 4s-электрона, проявляя степень окисления +2.
Строение атома кальция не допускает существования возбужденных состояний. При переходе в соединения кальций всегда образует ион Ca2+.
Такое электронное и пространственное устройство атома во многом определяет физическую природу и химические свойства кальция. Рассмотрим подробнее, как именно.
- Кальций проявляет высокую химическую активность, так как легко отдает два 4s электрона
- Со всеми неметаллами кальций образует бинарные соединения с ионной связью, переходя в ион Ca2+
- С металлами кальций образует интерметаллиды с металлической связью
- Заряд ядра +20 определяет положение кальция в периодической системе с атомным номером 20
Таким образом, заглянув в микромир атома кальция, мы выяснили причины многих его уникальных свойств, важных в промышленности, строительстве, медицине и других областях.
III. Применение знаний о строении в практике
Информация о внутреннем устройстве атома позволяет нам эффективно использовать кальций на практике. К примеру, по характерным реакциям с участием кальция можно определить состав неизвестного вещества, содержащего этот элемент. Давайте рассмотрим некоторые из таких качественных реакций:
- При взаимодействии кальция с кислотой выделяется водород: Ca + 2HCl → CaCl2 + H2↑
- Кальций активно реагирует с водой с образованием гидроксида: Ca + 2H2O → Ca(OH)2 + H2↑
- Пламя спиртовки, в которое вносят соль кальция, окрашивается в кирпично-красный цвет
Зная строение атома кальция и его положение в таблице Менделеева, можно предсказать свойства образуемых им химических соединений. Мы знаем, что кальций проявляет степень окисления +2, следовательно, в его солях это также будет ион Ca2+.
Опираясь на закономерности Периодической системы, можно заключить, что соли кальция будут по большей части плохо растворимы в воде, кроме галогенидов. Это объясняется малым радиусом и высоким зарядом иона Ca2+, из-за чего связь с анионами оказывается очень прочной.
Также знания об электронном строении позволяют делать вычисления с участием кальция. Например, уравнивать уравнения окислительно-восстановительных реакций, где кальций выступает восстановителем, отдавая два электрона; рассчитывать массовую долю химических элементов в сложных веществах, используя относительную атомную массу кальция, равную 40 а.е.м. И так далее.

IV. Роль кальция в живых организмах
Кальций играет чрезвычайно важную роль в живых организмах, в том числе и в организме человека. Благодаря своим химическим свойствам, обусловленным строением атома, кальций выполняет множество функций.
Во-первых, основная масса кальция в организме сосредоточена в костях и зубах в виде фосфата и гидроксиапатита кальция. Эти соединения придают скелету прочность и твердость, поддерживают минеральный гомеостаз.
Кроме того, ионы Ca2+ играют роль важных внутриклеточных посредников, запуская каскады биохимических реакций. Они участвуют в передаче нервных импульсов, в сокращении мышц, в высвобождении гормонов и других процессах.
V. Получение кальция в лаборатории и промышленности
Несмотря на широкое распространение кальция в природе, его промышленное производство имеет свои тонкости. В лаборатории обычно используют электролиз расплава хлорида кальция CaCl2 при температуре около 1000°С.
В промышленности чаще применяют метод восстановления оксида кальция алюминием или кремнием при 1500-2000°С:
CaO + Si → Ca + SiO
Сам процесс ведут в вакууме или инертной атмосфере, чтобы избежать окисления кальция. Затем полученный расплав отливают в формы или гранулируют.
VI. Влияние давления на свойства кальция
Одно из удивительных свойств кальция заключается в том, что при высоком давлении он становится полупроводником. Это связано с перекрыванием электронных орбиталей и изменением зонной структуры.
После дальнейшего повышения давления кальций вновь переходит в металлическое состояние и даже проявляет сверхпроводимость при соответствующей температуре. При этом его проводимость значительно возрастает.
Это иллюстрирует, насколько строение атома и свойства вещества связаны между собой. Меняя внешние условия, можно резко изменить поведение химического элемента.
VII. Применение кальция в различных областях
Благодаря совокупности свойств, кальций и его соединения находят широкое применение в промышленности, металлургии, строительстве, сельском хозяйстве, пищевой отрасли, медицине.
Например, гашеную известь (гидроксид кальция) и гипс (сульфат) используют для изготовления цемента и бетона, вяжущих для строительных растворов. Мрамор и известняк служат облицовочным материалом.
Хлорид и гидроксид кальция применяются для осушки газов, бромид используется в органическом синтезе. Также соли кальция входят в состав удобрений и кормов для животных.
Похожие статьи
- Знак зодиака Скорпион (мужчина): характеристика и совместимость с другими астрологическими знаками
- Общая характеристика русской литературы 19 века: описание, особенности и интересные факты
- Информатика – это наука... Что изучает информатика?
- Характеристика Льва-женщины. Знак Зодиака Лев: описание
- Как узнать свое тотемное животное по дате рождения
- Речь: классификация речи, виды и стили речи. Устная и письменная речь
- Где провести выпускной для 4 класса: интересные идеи и рекомендации
