Сульфид аммония: получение, гидролиз, применение
Азот - один из важнейших элементов органической химии. В виде сложных соединений элемент N является важной частью белков, из которых состоят все живые организмы на нашей планете. Этот достаточно активный химический элемент образует множество соединений, одним из которых является соединение аммония.
Что это такое
В молекуле аммиака азот охватывает своими ковалентными связями три атома водорода, причем последняя электронная связь остается свободной. Таким образом, аммоний может выступать донором различных химических реакций, образовывая четвертую – незатраченную ковалентную связь с другими веществами и соединениями. Если такое соединение происходит с атомом водорода, образуется молекула NH4. Полученный элемент может реагировать с различными кислотами, которые находятся в растворенном или концентрированном виде. При взаимодействии аммиак их нейтрализует. В итоге реакции получаются соли аммония - термически неустойчивые соединения. Если соль аммония нагревать, она быстро разлагается на составляющие вещества. При повышении температуры образуется аммиак с кислотой. Возможен и обратный процесс. Например, при взаимодействии с сероводородной кислотой можно получить сульфид аммония.
Формула
Это соединение записывается в химических уравнениях в видеследующей формулы.
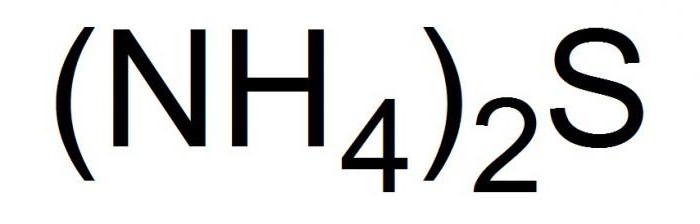

Распространенные химические реакции
Гидролиз сульфида аммония отличается от других реакций подобных солей тем, что в ней принимают участие и катионы, и анионы одного и того же вещества. Процесс реакции зависит от температуры. Гидролиз сульфида аммония может быть записан следующим образом:
- ионное уравнение гидролиза по катиону:
NH4 + +H2O = NH3*H2O + H+; - уравнение гидролиза по аниону проходит в два этапа:
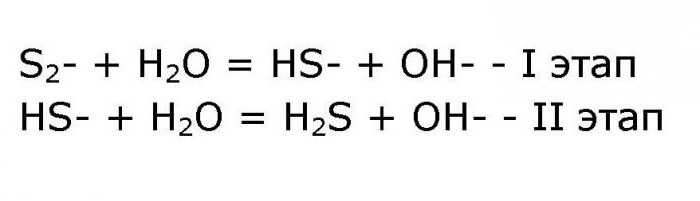
Итоговое ионное уравнение реакции выглядит следующим образом:
- NH4 + +S2- + 2H2O = NH3*H2O + HS- + H+ + OH-.
Стандартная запись этой химической реакции выглядит так:
- (NH4)2S + 2H2O = NH3*H2O + NH4HS + H2O.
Без нагревания реакция может быть обратима и происходит по первой ступени. Но если вещество подогреть, реакция станет необратимой – конечные вещества аммиак и сероводород просто покидают поле взаимодействия и улетучиваются.
Получение сульфида аммония
Сульфид аммония чаще всего получают при взаимодействии сероводорода с избытком аммиака:
H2S + 2 NH3 → (NH4)2S.
Одной из наиболее характерных особенностей этого соединения является полное разложение соединения в воде. Цепь химической реакции выгладит следующим образом:
(NH4)2S → 2NH4+ + S2-
NH4+ + H2O ↔ NH3·H2O + H+
S2- + H2O ↔ HS- + OH-
Сульфид аммиака в воде распадается на аммиак и сероводород.

Дальнейшее разложение сопровождается выделением водорода и появлением растворенного в воде аммиака и слабого аниона HS- . Поэтому в таблицах, поясняющих раствормость химических элементов, сульфид аммония помечен пропуском.
Практическое применение
В промышленности практическое применение разработано для паров сульфида аммония. Жидкая форма этого соединения используется при транспортировке. Хранят его в закрытых, химически инертных емкостях.

Это вещество хорошо знакомо фотографам и текстильщикам. В фотографии это соединение используется для обработки пленки. При взаимодействии с сильными основаниями происходит химическая реакция, сопровождающаяся выделением вредных веществ. В текстильной промышленности сульфид аммония используется как компонент отбеливающих смесей. Металлурги и реставраторы успешно пользуются им для превращения патины в бронзу. Сульфид аммония непременно используется при производстве мочевины, как важного удобрения, а также при производстве соды.
Возможно, применение этого вещества в хозяйственной деятельности было бы более распространенным. Но из-за чрезвычайной летучести этого соединения оно довольно быстро вступает в химическую реакцию с водяным паром, содержащимся в воздухе. Конечным продуктом этого взаимодействия является сероводород, который славится своим резким и очень неприятным запахом. Именно эта особенность сульфида аммония стала причиной его использования в производстве продукции для розыгрышей, включая «вонючие бомбы» и прочее.
Похожие статьи
- Сульфат аммония: формула, состав, получение и применение
- Соли аммония: свойства. Соли аммония: применение
- Карбонат аммония: получение, химические свойства, спектр применения
- Химические свойства цинка и его соединений
- Что такое висмут, его свойства, соединения, получение и применение
- Дихромат калия: получение, применение, волшебные реакции с участием реагента
- Структурная формула нитробензола
