Свойства солей: физические и химические
Каждый день мы сталкиваемся с солями и даже не задумываемся, какую роль они играют в нашей жизни. А ведь без них и вода была бы не такой вкусной, и пища не приносила бы удовольствия, и растения не росли, да и жизнь на земле не могла бы существовать, не будь в нашем мире соли. Так что же это за вещества и какие свойства солей делают их незаменимыми?
Что такое соли
По своему составу это самый многочисленный класс, отличающийся разнообразием. Еще в 19 веке химик Й. Верцелиус дал определение соли — это продукт реакции между кислотой и основанием, при которой водородный атом заменяется металлическим. В воде обычно соли диссоциируют на металл или аммоний (катион) и кислотный остаток (анион).

Получить соли можно следующими способами:
- путем взаимодействия металла и неметалла, в этом случае она будет бескислородная;
- при взаимодействии металла с кислотой получается соль и выделяется водород;
- металл может вытеснять другой металл из раствора;
- при взаимодействии двух оксидов — кислотного и основного (еще их называют оксидом неметалла и оксидом металла соответственно);
- при реакции оксида металла и кислоты получаются соль и вода;
- реакция между основанием и оксидом неметалла также дает соль и воду;
- с помощью реакции ионного обмена, при этом могут реагировать разные растворимые в воде вещества (основания, кислоты, соли), но протекать реакция будет, если образуется газ, вода или соли слаборастворимые (нерастворимые) в воде.
Только от химического состава свойства солей и зависят. Но для начала разберемся в их классах.
Классификация
В зависимости от состава выделяют следующие классы солей:
- по содержанию кислорода (кислородсодержащие и бескислородные);
- по взаимодействию с водой (растворимые, малорастворимые и нерастворимые).
Такая классификация отражает все многообразие веществ не полностью. Современная и наиболее полная классификация, отражающая не только состав, но и свойства солей, представлена в следующей таблице.
| Соли | |||||
|---|---|---|---|---|---|
| Нормальные | Кислые | Основные | Двойные | Смешанные | Комплексные |
| Водород полностью замещен | Атомы водорода замещены на металл не полностью | Группы оснований замещены на кислотный остаток не полностью | В составе два металла и один кислотный остаток | В составе один металл и два кислотных остатка | Сложные вещества, состоящие из комплексного катиона и аниона или катиона и комплексного аниона |
| NaCl | KHSO4 | FeOHSO3 | KNaSO4 | CaClBr | [Cu(NH3)4]SO4 |
Физические свойства
Как бы ни был широк класс этих веществ, но общие физические свойства солей выделить возможно. Это вещества немолекулярного строения, с ионной кристаллической решеткой.
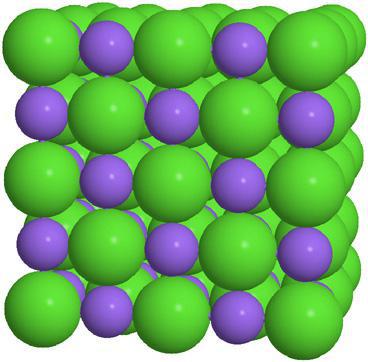
Очень высокие точки плавления и кипения. При нормальных условиях все соли не проводят электричество, но в растворе большинство из них прекрасно проводит ток.
Цвет может быть самым разным, он зависит от иона металла, входящего в ее состав. Сульфат железа (FeSO4) — зеленый, хлорид железа (FeCl3) — темно-красный, а хромат калия (K2CrO4) красивого ярко-желтого цвета. Но большинство солей все-таки бесцветные или белые.

Растворимость в воде также бывает различной и зависит от состава ионов. В принципе, все физические свойства солей имеют особенность. Они зависят от того, ион какого металла и какой кислотный остаток включены в состав. Продолжим рассматривать соли.
Химические свойства солей
Здесь тоже есть важная особенность. Как и физические, химические свойства солей зависят от их состава. А также от того, к какому классу они относятся.

Но общие свойства солей можно все-таки выделить:
- многие из них разлагаются при нагревании с образованием двух оксидов: кислотного и основного, а бескислородные — металла и неметалла;
- взаимодействуют соли и с другими кислотами, но реакция идет, только если в составе соли кислотный остаток слабой или летучей кислоты или в результате получается нерастворимая соль;
- взаимодействие со щелочью возможно, если катион образует нерастворимое основание;
- возможна реакция и между двумя разными солями, но только если одна из вновь образовавшихся солей не растворяется в воде;
- может происходить и реакция с металлом, но она возможна, только если брать металл, расположенный правее в ряду напряжения от металла, содержащегося в соли.
Химические свойства солей, относящихся к нормальным, рассмотрены выше, другие же классы реагируют с веществами несколько иначе. Но отличие идет только по продуктам на выходе. В основном все химические свойства солей сохраняются, как и требования к протеканию реакций.
Похожие статьи
- Соли аммония: свойства. Соли аммония: применение
- Формула и свойства поваренной соли. Применение поваренной соли
- Что такое соль? Формула, свойства соли (химия)
- Эпсом-соль - английская соль: лечебные свойства и применение
- Черная соль: польза и вред
- Натрий гипохлорит: формула, применение. Обеззараживание воды гипохлоритом натрия
- Компресс солевой: особенности применения, противопоказания и отзывы
