Арены: химические свойства и способы получения

Ароматические химические соединения, или арены, представляют собой большую группу карбоциклических соединений, в молекулах которых содержится устойчивый цикл из шести углеродных атомов. Она носит название «бензольное кольцо» и обуславливает особые физические и химические свойства аренов.
К ароматическим углеводородам относится в первую очередь бензол и всевозможные его гомологи и производные.
В молекулах аренов может содержаться несколько бензольных колец. Такие соединения называют многоядерными ароматическими соединениями. Например, нафталин - всем известный препарат для защиты шерстяных изделий от моли.
Бензол
Этот простейший представитель аренов состоит только из бензольного кольца. Его молекулярная формула С6Η6. Структурную формулу молекулы бензола чаще всего представляют циклической формой, предложенной А. Кекуле в 1865 году.
Достоинством этой формулы является верное отражение состава и равноценности всех атомов С и Н в кольце. Однако она не могла объяснить многих химических свойств аренов, поэтому утверждение о наличии трех сопряженных двойных связей С=С является ошибочным. Это стало известно лишь с появлением современной теории связей.
Между тем и сегодня часто встречается написание формулы бензола способом, предложенным Кекуле. Во-первых, с ее помощью удобно записывать уравнения химических реакций. Во-вторых, современные химики видят в ней лишь символ, а не реальную структуру. Строение молекулы бензола сегодня передают различными типами структурных формул.
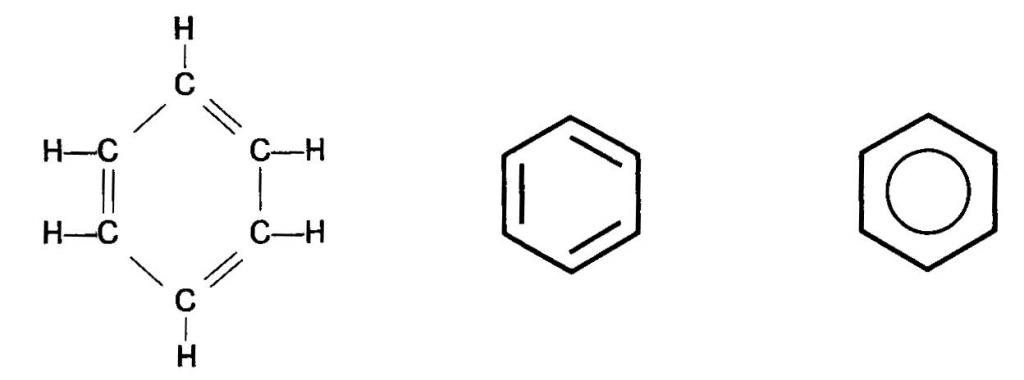
Строение бензольного кольца
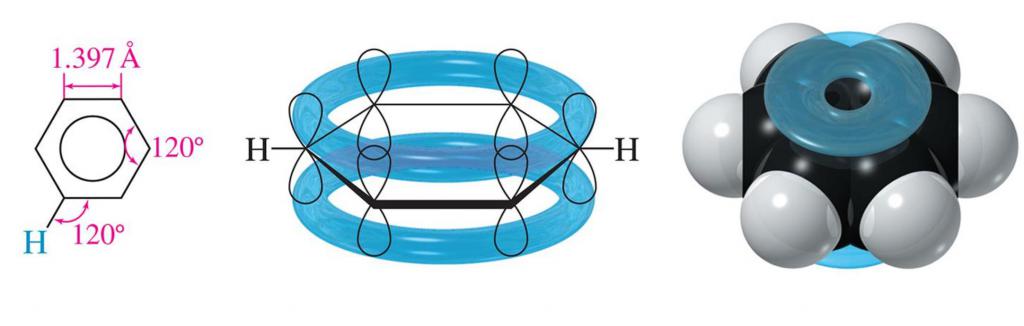
Главной особенностью бензольного ядра можно назвать отсутствие в нем одинарных и двойных связей в традиционном понимании. В соответствии с современными представлениями молекула бензола представляется плоским шестиугольником с длинами сторон равными 0,140 нм. Получается, что длина связи С-С в бензоле является промежуточным значением между одинарной (ее длина 0,154 нм) и двойной (0,134 нм). В той же плоскости лежат и связи С–Н, образующие с ребрами шестиугольника угол в 120°.
Каждый атом С в структуре бензола находится в sp2-гибридном состоянии. Он соединен посредством трех своих гибридных орбиталей с двумя атомами С, расположенными по соседству, и одним атомом Н. То есть образует три s-связи. Еще одна, но уже негибридизованная его 2р-орбиталь, перекрывается с такими же орбиталями соседних атомов С (справа и слева). Ось ее перпендикулярна плоскости кольца, а значит перекрывание орбиталей происходит над и под ней. При этом образуется общая замкнутая π-электронная система. Из-за равнозначного перекрывания 2р-орбиталей шести атомов С происходит своего рода «уравнивание» связей С-С и С=С.
Результатом этого процесса является сходство таких «полуторных» связей и с двойными, и с одинарными. Этим объясняется тот факт, что проявляют арены химические свойства, характерные и для алканов, и для алкенов.
Энергия углерод-углеродной связи в бензольном кольце равняется 490 кДж/моль. Что также является также средней величиной между энергиями простой и кратной двойной связи.
Номенклатура аренов
Основой названий ароматических углеводородов является бензол. Атомы в кольце нумеруют со старшего заместителя. Если же заместители равнозначны, то нумерацию осуществляют по кратчайшему пути.
Для многих гомологов бензола часто используют тривиальные названия: стирол, толуол, ксилол и т. д. Для отражения взаимного расположения заместителей принято использовать приставки οртο-, мета-, пара-.
Если в молекуле имеются функциональные группы, например, карбонильная или карбоксильная, то молекулу арена рассматривают как соединенный с ней ароматический радикал. Например, -С6Η5 – фенил, -C6Η4 – фенилен, С6Η5—СΗ2— – бензил.
Физические свойства
Первые представители в гомологическом ряду бензола – это бесцветные жидкости, имеющие специфический запах. Их вес легче воды, в которой они практически не растворяются, но хорошо растворяются в большинстве органических растворителей.
Все ароматические углеводороды горят с появлением коптящего пламени, что объясняется высоким содержанием С в молекулах. Температуры плавления и кипения их повышаются с увеличением значений молекулярных масс в гомологическом ряду бензола.
Химические свойства бензола
Из разнообразных химических свойств аренов реакции замещения следует упомянуть отдельно. Также весьма значимы некоторые реакции присоединения, осуществляющиеся в особых условиях, и процессы окисления.
Реакции замещения
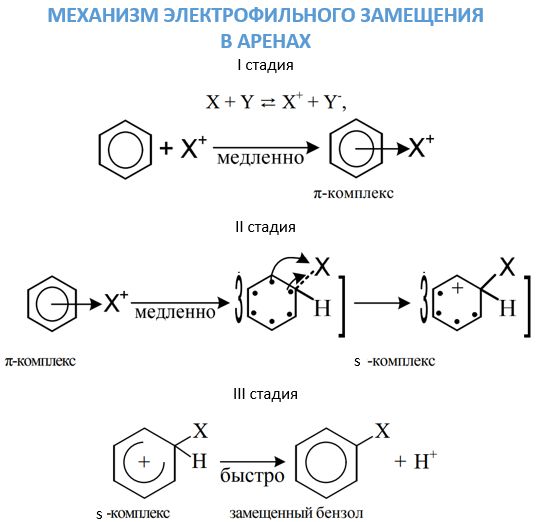
Довольно подвижные π-электроны бензольного кольца, способны очень активно реагировать с атакующими электрофилами. В таком электрофильном замещении участвует само бензольное ядро в бензоле и связанная с ним углеводородная цепь в его гомологах. Механизм этого процесса довольно подробно изучен органической химией. Химические свойства аренов, связанные с атакой электрофилов, проявляются посредством трех стадий.
- Первая стадия. Появление π-комплекса из-за связывания π-электронной системы бензольного ядра с частицей Х+, которая связывается с шестью π-электронами.
- Вторая стадия. Переход π-комплекса в s, обусловленный выделением из шести π-электронов пары для образования ковалентной связи С—X. А остальные четыре перераспределяются между пятью атомами С в бензольном кольце.
- Третья стадия. Сопровождается быстрым отщеплением протона от s-комплекса.
Бромирование бензола в присутствии бромидов железа или алюминия без нагревания приводит к получению бромбензола:
C6Η6+ Br2 —> C6Η5-Br + ΗBr.
Нитрование смесью азотной и серной кислот приводит к получению соединений с нитрогруппой в кольце:
C6Η6+ ΗONO2 —> C6Η5—NO2+ Η2O.
Сульфирование осуществляется бисульфониевым ионом, образующимся в результате реакции:
3Η2SO4 ⇄ SO3Η++ Η3O++ 2ΗSO4-,
или триоксид серы.
Соответствует данному химическому свойству аренов реакция:
C6H6+ SO3H+ —> C6H5—SO3H + H+.
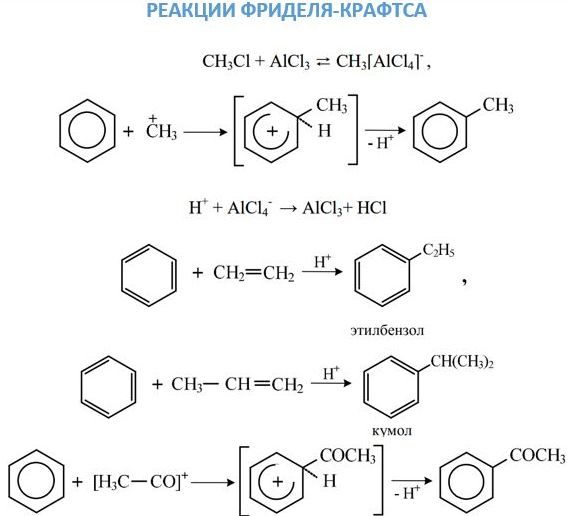
Реакции алкильного и ацильного замещения, или реакции Фриделя–Крафтса, проводят в присутствии безводного AlCl3.
Эти реакции маловероятны для бензола и протекают с трудом. Присоединение галогеноводородов и воды к бензолу не происходит. Однако при очень высоких температурах в присутствии платины возможна реакция гидрирования:
С6Η6 + 3Н2 —> С6Н12.
При облучении ультрафиолетом к молекуле бензола могут присоединиться молекулы хлора:
С6Η6 + 3Cl2 —> C6Η6Cl6.
Реакции окисления
Бензол весьма устойчив к окислителям. Так, он не обесцвечивает розовый раствор перманганата калия. Однако в присутствии оксида ванадия он может окисляться кислородом воздуха до малеиновой кислоты:
С6Н6 + 4О —> СООΗ-СΗ=СΗ-СООΗ.
На воздухе бензол горит с появлением копоти:
2C6Η6 + 3O2 → 12C + 6Η2O.
Химические свойства аренов
- Замещение.
- Галогенирование может идти разными путями в зависимости от условия проведения реакции. В присутствии соответствующего галогенида железа или алюминия замещение будет идти в кольце по механизму, подробно описанному выше. Чтобы атом галогена ввести в боковую цепь, взаимодействие проводят при нагревании без катализаторов или на свету.
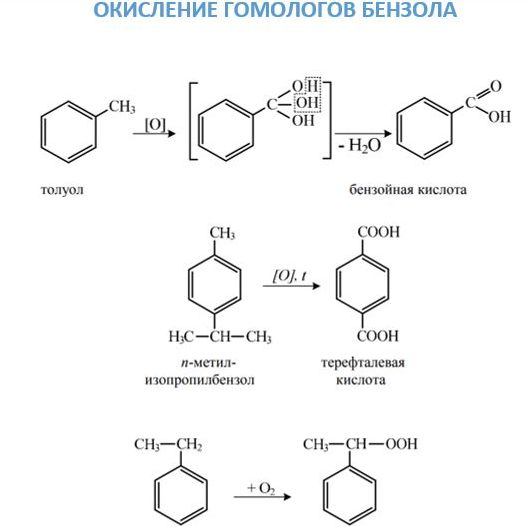
- Нитрование ароматических углеводородов ионом нитрония, который образуется при смешивании серной и азотной кислоты, приводит к соединению нитрогруппы с бензольным ядром. Соединение нитрогруппы с боковой цепью возможно при проведении реакции Коновалова. 2. Окисление. Данное химическое свойство аренов можно рассматривать с двух точек зрения. С одной, они довольно легко окисляются, причем действию подвергается боковая цепь с образованием карбоксильной группы. Если в молекуле ароматического углеводорода с кольцом соединены два заместителя, то образуется двухосновная кислота. С другой стороны, они, как и бензол, горят с образованием сажи и воды.
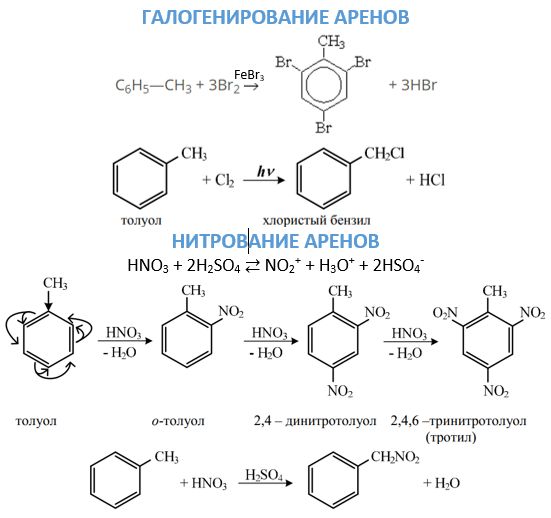
Правила ориентации
Какое именно положение (о-, м- или п-) займет заместитель в ходе взаимодействия электрофильного агента с бензольным кольцом определяется правилами:
- если в бензольном ядре уже имеется какой-либо заместитель, то именно он направляет входящую группу в определенное положение;
- все ориентирующие заместители делят на две группы: ориентанты первого рода направляют поступающую группу атомов в орто- и пара-положения (—NΗ2, —ОΗ,—СΗ3, —С2Н5, галогены); ориентанты второго рода направляют вступающие заместители в мета-положение (—NO2, —SO3Η, —СΗО, —СООΗ).
Ориентанты здесь указаны в порядке уменьшения направляющей силы.
Стоит отметить, что такое разделение заместителей группы является условным, из-за того, в большинстве реакций наблюдается образование всех трех изомеров. Ориентанты же влияют лишь на то, какой из изомеров будет получен в большем количестве.
Получение аренов
Основными источниками аренов являются сухая перегонка каменного угля и нефтепереработка. В каменноугольной смоле содержится огромное количество всевозможных ароматических углеводородов. В некоторых сортах нефти содержится до 60% аренов, которые несложно выделить простой перегонкой, пиролизом или крекингом.
Способы синтетического получения и химические свойства аренов зачастую бывают взаимосвязаны. Бензол, как и его гомологи, получают одним из следующих способов.
1. Риформинг нефтепродуктов. Дегидрирование алканов – важнейший промышленный способ синтеза бензола и многих его гомологов. Реакцию ведут при пропускании газов над нагретым катализатором (Pt, Cr2O3, оксиды Mo и V) при t = 350–450 оС:
С6Н14 —> С6Η6 + 4Η2.
2. Реакция Вюрца–Фиттига. Она осуществляется через стадию получения металлорганических соединений. В итоге реакции возможно получение нескольких продуктов.
3. Тримеризация ацетилена. Сам ацетилен, как и его гомологи способны образовывать арены при нагревании с катализатором:
3С2Η2 —> С6Η6.
4. Реакция Фриделя–Крафтса. Выше уже был рассмотрен в химических свойствах аренов способ получения и превращения гомологов бензола.
5. Получение из соответствующих солей. Бензол можно выделить при перегонке солей бензойной кислоты со щелочью:
C6Η5—COONa + NaOΗ —> C6Η6 + Na2CO3.
6. Восстановлением кетонов:
C6Η5–CO–CΗ3 + Zn + 2ΗCl —> C6Η5–CΗ2–CΗ3 + Η2O + ZnCl2;
CΗ3–C6Η5–CO–CΗ3+ NΗ2–NΗ2 —> CΗ3–C6Η5–CΗ2–CΗ3+ Η2O.
Применение аренов
Химические свойства и области применения аренов имеют прямую взаимосвязь, поскольку основная часть ароматических соединений идет для дальнейшего синтеза в химическом производстве, а не используется в готовом виде. Исключение составляют вещества, применяемые в качестве растворителей.
Бензол С6Η6 применяется по большей части в синтезе этилбензола, кумола и циклогексана. На его основе получают полупродукты для изготовления различных полимеров: каучуков, пластмасс, волокон, красителей, ПАВ, инсектицидов, лекарств.

Толуол С6Н5-СН3 используют при производстве красителей, лекарств и взрывчатых веществ.
Ксилолы С6Η4(СΗ3)2 в смешанном виде (технический ксилол) применяются в качестве растворителя или исходного препарата для синтеза органических веществ.
Изопропилбензол (или кумол) С6Η4-СΗ(СΗ3)2 является исходным реагентом для синтеза фенола и ацетона.
Винилбензол (стирол) C6Η5-CΗ=СΗ2 является сырьем для получения важнейшего полимерного материала – полистирола.
Похожие статьи
- Химические свойства аренов. Общая формула и характеристика аренов
- Как составить изомеры: формулы
- Бензол: формула. Бензол: электронное строение, свойства
- Что такое нафталин? Свойства вещества, сферы применения
- Ароматические углеводороды: все о них
- Циклоалканы: химические свойства, применение
- Химические свойства алкадиенов - непредельных углеводородов


