Ароматические углеводороды: все о них
Химия — очень увлекательная наука. Она изучает все вещества, которые существуют в природе, а их огромное множество. Они разделяются на неорганические и органические. В этой статье мы рассмотрим ароматические углеводороды, которые относятся к последней группе.
Что это такое?
Это органические вещества, которые имеют в своем составе одно или несколько бензольных ядер — устойчивых структур из шести атомов углерода, соединенных в многоугольник. Данные химические соединения обладают специфическим запахом, что можно понять из их названия. Углеводороды этой группы относятся к циклическим, в отличие от алканов, алкинов и др.
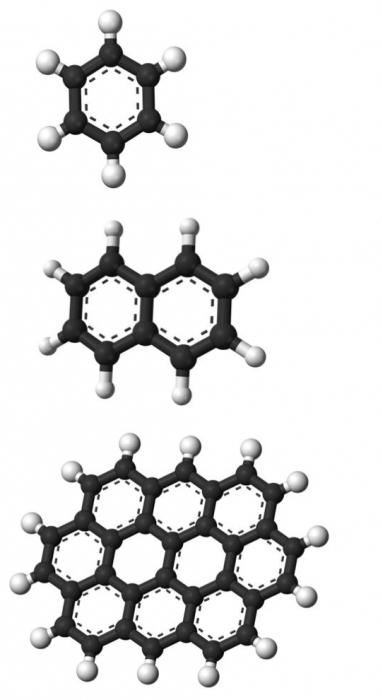
Ароматические углеводороды. Бензол
Это самое простое химическое соедиение из данной группы веществ. В состав его молекул входят шесть атомов углерода и столько же гидрогена. Все остальные ароматические углеводороды являются производными бензола и могут быть получены с его использованием. Это вещество при нормальных условиях находится в жидком состоянии, оно бесцветное, обладает специфическим сладковатым запахом, в воде не растворяется. Закипать оно начинает при температуре +80 градусов по Цельсию, а замерзать — при +5.
Химические свойства бензола и других ароматических углеводородов
Первое, на что нужно обратить внимание, — галогенирование и нитрование.
Реакции замещения
Первая из них — галогенирование. В этом случае, чтобы химическое взаимодействие могло осуществиться, нужно использовать катализатор, а именно трихлорид железа. Таким образом, если добавить к бензолу (С6Н6) хлор (Cl2), то мы получим хлорбензол (С6Н5Cl) и хлороводород (HCl), который выделится в виде прозрачного газа с резким запахом. То есть вследствие этой реакции один атом водорода замещается атомом хлора. То же самое может произойти и при добавлении к бензолу других галогенов (йода, брома и т. д.). Вторая реакция замещения — нитрование — проходит по похожему принципу. Здесь в роли катализатора выступает концентрированный раствор серной кислоты. Для проведения такого рода химической реакции к бензолу необходимо добавить нитратную кислоту (HNO3), тоже концентрированную, в результате чего образуются нитробензол (C6H5NO2) и вода. В этом случае атом гидрогена замещается группой из атома нитрогена и двух оксигена.
Реакции присоединения
Это второй тип химических взаимодействий, в которые способны вступать ароматические углеводороды. Они также существуют двух видов: галогенирование и гидрирование. Первая происходит только при наличии солнечной энергии, которая выступает в роли катализатора. Для проведения этой реакции к бензолу также необходимо добавить хлор, но в большем количестве, чем для замещения. На одну молекулу бензола должно приходиться три хлора. В результате получим гексахлорциклогексан (С6Н6Cl6), то есть к имеющимся атомам присоединится еще и шесть хлора.
Гидрирование происходит только в присутствии никеля. Для этого необходимо смешать бензол и гидроген (Н2). Пропорции те же, что и в предыдущей реакции. Вследствие этого образуется циклогексан (С6Н12). Все остальные ароматические углеводороды также могут вступать в такого типа реакции. Они происходят по такому же принципу, как и в случае с бензолом, только с образованием уже более сложных веществ.
Получение химических веществ этой группы
Начнем все так же с бензола. Его можно получить с помощью такого реагента, как ацетилен (С2Н2). Из трех молекул данного вещества под воздействием высокой температуры и катализатора образуется одна молекула нужного химического соединения.
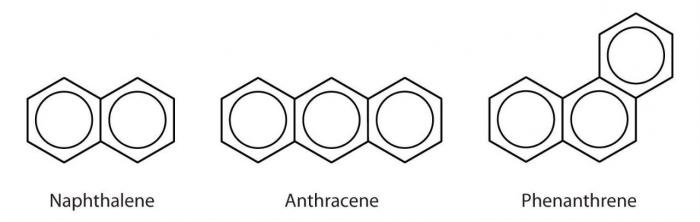
Также бензол и некоторые другие ароматические углеводороды можно добыть из каменноугольной смолы, которая образуется во время производства металлургического кокса. К получаемым таким способом можно отнести толуол, о-ксилол, м-ксилол, фенантрен, нафталин, антрацен, флуорен, хризен, дифенил и другие. Кроме того, вещества этой группы часто добывают из продуктов переработки нефти.
Как выглядят разнообразные химические соединения этого класса?
Стирол представляет собой бесцветную жидкость с приятным запахом, малорастворимую в воде, температура кипения составляет +145 градусов по Цельсию. Нафталин — кристаллическое вещество, также мало растворяется в воде, плавится при температуре +80 градусов, а закипает при +217. Антрацен в нормальных условиях также представлен в виде кристаллов, однако уже не бесцветных, а имеющих желтую окраску. Это вещество не растворяется ни в воде, ни в органических растворителях. Температура плавления — +216 градусов по шкале Цельсия, кипения — +342. Фенантрен выглядит как блестящие кристалы, которые растворяются только в органических растворителях. Температура плавления — +101 градус, кипения — +340 градусов. Флуорен, как понятно из названия, способен к флуоресценции. Это, как и многие другие вещества данной группы, — бесцветные кристаллы, нерастворимые в воде. Температура плавления — +116, закипания — +294.
Применение ароматических углеводородов
Бензол используется при производстве красителей в качестве сырья. Также он применяется при получении взрывчатки, пестицидов, некоторых лекарств. Стирол используют в производстве полистирола (пенопласта) с помощью полимеризации исходного вещества. Последний широко применяют в строительстве: в качестве тепло- и звукоизолирующего, электроизоляционного материала. Нафталин, как и бензол, участвует в производстве пестицидов, красителей, лекарств. Кроме того, он используется в химической промышленности для получения многих органических соединений. Антрацен также применяют в изготовлении красителей. Флуорен играет роль стабилизатора полимеров. Фенантрен, как и предыдущее вещество и многие другие ароматические углеводороды, — один из компонентов красителей. Толуол широко применяют в химической промышленности для добывания органических веществ, а также для получения взрывчатки.

Характеристика и использование веществ, добываемых с помощью ароматических углеводородов
К таким в первую очередь можно отнести продукты рассмотренных химических реакций бензола. Хлорбензол, к примеру, является органическим растворителем, также используется в производстве фенола, пестицидов, органических веществ. Нитробензол является компонентом полировальных средств для металла, применяется при изготовлении некоторых краситлей и ароматизаторов, может играть роль растворителя и окислителя. Гексахлорциклогексан используется в качестве яда для борьбы с насекомыми-вредителями, а также в химической промышленности. Циклогексан применяют в производстве лакокрасочных изделий, при получении многих органических соединений, в фарамацевтической отрасли промышленности.
Заключение
Прочитав эту статью, можно сделать вывод, что все ароматические углеводороды имеют однотипную химическую структуру, что позволяет объединить их в один класс соединений. Кроме того, их физические и химические свойства также весьма похожи. Внешний вид, температуры кипения и плавления всех химических веществ данной группы не сильно отличаются. Свое применение многие ароматические углеводороды находят в одних и тех же отраслях промышленности. Вещества, которые можно получить вследствие реакций галогенирования, нитрования, гидрирования, также имеют схожие свойства и используются в похожих целях.
Похожие статьи
- Арены: химические свойства и способы получения
- Бензол: формула. Бензол: электронное строение, свойства
- Химические свойства аренов. Общая формула и характеристика аренов
- Ароматические диффузоры: описание, преимущества, как пользоваться?
- Что такое нафталин? Свойства вещества, сферы применения
- Химические и физические свойства аренов
- Органические вещества. Классы органических веществ
