Алюминий сульфат и другие соединения алюминия в природе и жизни человека
В повседневной жизни каждый из нас ежеминутно сталкивается с умопомрачительным количеством химических веществ, как природных, так и созданных самим человеком. Остановимся на двух химических соединениях: сульфат алюминия, гидроксид алюминия. Что это такое и почему стоит обратить на них внимание?
Чтобы познакомиться, нужно заземлиться
Алюминий сульфат (глинозём) наряду с алюмосиликатами и различными видами глины составляет основную массу земной коры. Это позволяет алюминию занимать первое место среди металлов по распространенности на Земле. В природе сульфат алюминия, формула которого Al2(SO4)*18H2O, является кристаллогидратом и представляет собой растворимые в воде кристаллы белого цвета с серым, голубым или розовым оттенком.

В отличие от алюминия сульфата, гидроксид его представляет собой белое твердое вещество, нерастворимое в воде. Алюминий сульфат, гидроксид алюминия, каолинит широко распространены. Их добывают в Сибири, Крыму, Китае, Японии, а также в странах Центральной и Южной Америки.
Зри в пробирку
Чтобы познать истину, определим, какими же химическими свойствами обладают сульфат и гидроксид Al. Перефразируем крылатое выражение Козьмы Пруткова «Зри в корень!» на более прагматичное: «Зри в пробирку!»


Рассматривая взаимодействие гидроксида алюминия Al(OH)3 со щелочами, будем внимательны и учтем условия, при которых происходит реакция. Именно от них будут зависеть конечные продукты:

Сам же гидроксид Al(OH)3 получают в лаборатории непрямым путем, то есть не из оксида и воды, что в этом случае невозможно, а из соли алюминия. Для этого берут раствор сульфата алюминия и действуют на него щелочью, например едким натром, осторожно вливая его по каплям.
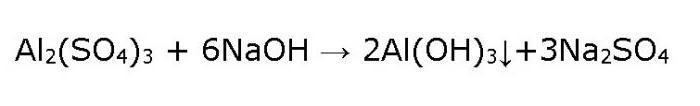
В результате в пробирке образуется студенистый осадок белого цвета – гидроксид Al(OH)3 .

Суммируя все выше приведенные реакции, доказывающие амфотерность гидроксида алюминия, сделаем вывод: в кислой среде химическое равновесие смещается в сторону образования солей Al, а в щелочной – в сторону образования метаалюминатов или гидроксоалюминатов.
Поддерживающий традиции
Отдохнем от сложностей «двуликости» амфотерного гидроксида алюминия и обратимся к традиционной средней соли – сульфату алюминия. Никаких отступлений от правил. Растворы средних солей реагируют со щелочами, с кислотами, с другими солями, с металлами, стоящими в ряду Бекетова (ряд напряжений металлов) до метала, ион которого содержится в молекуле соли. Например, алюминий сульфат в растворе будет реагировать с литием, калием, кальцием, натрием и магнием. Подтвердим это уравнениями реакций.
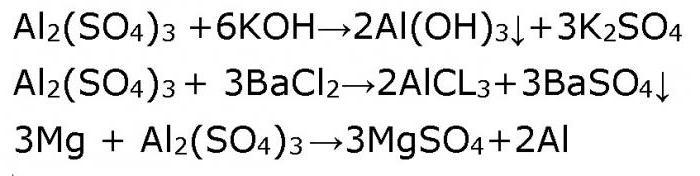
Сульфат алюминия, формула которого Al2(SO4)3, является продуктом взаимодействия слабого основания гидроксида алюминия Al(OH)3 и сильной сульфатной кислоты H2SO4. Поэтому в водном растворе он легко гидролизирует. Избыток ионов водорода H+ обнаруживается с помощью индикатора лакмуса, меняющего свой синий цвет в растворе сульфата алюминия на красный. Таким образом, мы устанавливаем, что раствор сульфата алюминия имеет кислую реакцию.

Можно было бы продолжить углубляться в приятные и волнующие для химика-эстета подробности данной темы, если бы вдали не замаячило подозрительно-скептическое лицо с вопросом: «Ну и что я с этого буду иметь?»
Они придут на помощь
Чтобы развеять все сомнения, скажем, что вы уже имеете массу полезных и даже жизненно необходимых вещей, благодаря таким соединениям, как алюминий сульфат, гидроксид алюминия и другим алюминийсодержащим реагентам. В первую очередь Al(OH)3 используют для очистки жесткой воды. После данного процесса вода становится прозрачнее и светлее и освобождается от солей, делающих ее жесткой.
В стремлении быть всегда красивыми и ухоженными нам помогают лосьоны, гели, тоники. А ведь они тоже содержат алюминий сульфат. Широко рекламируемая инновация в индустрии дезодорантов-антиперспирантов под названием «кристаллы свежести» – не что иное, как алюмокалиевые квасцы, компонентом которых является алюминий сульфат. Соединения алюминия имеют обволакивающую способность и поэтому используются также в производстве разноцветных хлопчатобумажных тканей и в фармакологии.
Похожие статьи
- Квасцы: что это такое, инструкция по применению
- Химические и физические свойства алюминия. Физические свойства гидроксида алюминия
- Степень и константа гидролиза
- Медный купорос: полная характеристика вещества
- Что такое алюминий: формула, реакции, свойства и применение
- Гидроксид алюминия - яркий представитель амфотерных гидроксидов
- Химические свойства цинка и его соединений
