Окислитель - это атом, принимающий электроны
Окислитель и восстановитель используют для составления реакции в органической и неорганической химии. Рассмотрим основные характеристики таких взаимодействий, выявим алгоритм составления уравнения и расстановки коэффициентов.

Определения
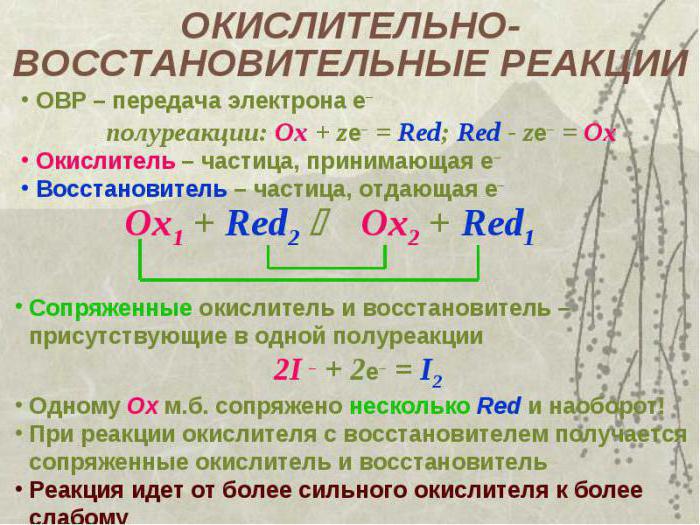
Окислитель - это атом либо ион, который при взаимодействии с другими элементами принимает электроны. Процесс принятия электронов называют восстановлением, и связан он с понижением степени окисления.
В курсе неорганической химии рассматривается два основных метода расстановки коэффициентов. Восстановитель и окислитель в реакциях определяют путем составления электронного баланса либо методом полуреакций. Подробнее остановимся на первом способе расставления коэффициентов в ОВР.
Степени окисления
Прежде чем определять окислитель в реакции, нужно расставить степени окисления у всех элементов в веществах, участвующих в превращении. Она представляет собой заряд атома элемента, вычисленный по определенным правилам. В сложных веществах сумма всех положительных и отрицательных степеней окисления должна быть равна нулю. Для металлов главных подгрупп она соответствует валентности и имеет положительную величину.
Для неметаллов, которые в формуле располагаются в конце, степень определяется путем вычитания из восьми номера группы и имеет отрицательное значение.
У простых веществ она равна нулю, так как не наблюдается процесса принятия или отдачи электронов.
У сложных соединений, состоящих из нескольких химических элементов, для определения степеней окисления используют математические вычисления.
Итак, окислитель - это атом, который в процессе взаимодействия понижает свою степень окисления, а восстановитель, напротив, повышает ее значение.
Примеры ОВР
Основной особенностью заданий, связанных с расстановкой коэффициентов в окислительно-восстановительных реакциях, является определение пропущенных веществ и составление их формул. Окислитель - это элемент, который будет принимать электроны, но помимо него в реакции должен участвовать и восстановитель, отдающий их.
Приведем обобщенный алгоритм, по которому можно выполнять задания, предлагаемые выпускникам старшей школы на едином государственном экзамене. Рассмотрим несколько конкретных примеров, чтобы понять, что окислитель - это не только элемент в сложном веществе, но и простое вещество.
Сначала необходимо расставить у каждого элемента значения степеней окисления, используя определенные правила.
Далее нужно проанализировать элементы, которые не участвовали в образовании веществ, и составить для них формулы. После того как все пропуски будут ликвидированы, можно переходить к процессу составления электронного баланса между окислителем и восстановителем. Полученные коэффициенты ставят в уравнение, при необходимости добавляя их перед теми веществами, которые не вошли в баланс.
Например, пользуясь методом электронного баланса, необходимо завершить предложенное уравнение, расставить перед формулами необходимые коэффициенты.
H2O2 + H2SO4 +KMnO4 = MnSO4 + O2 + …+…
Для начала у каждого определим значения степеней окисления, получим
H2+O2 -+ H2+S+6O4 -2+K+Mn+7O4 -2= Mn+2S+6O4 -2+ O2 0+ …+…
В предложенной схеме они меняются у кислорода, а также у марганца в перманганате калия. Таким образом, восстановитель и окислитель нами найдены. В правой части отсутствует вещество, в котором бы был калий, поэтому вместо пропусков составим формулу его сульфата.
Далее запишем электронный баланс. Кислород в данном случае будет проявлять восстановительные свойства, отдавая два электрона. Марганец принимает их, проявляя окислительную способность.
Последним действием в данном задании будет расстановка коэффициентов.
5H2O2 + 3H2SO4 +2KMnO4 = 2Mn SO4 + 5O2 + 8H2O + K2SO4
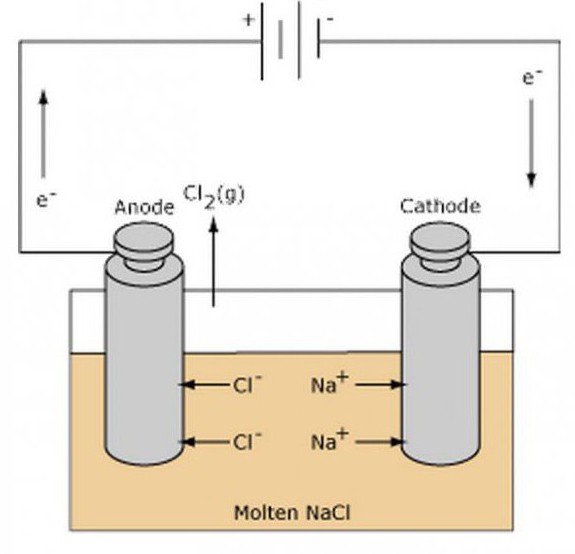
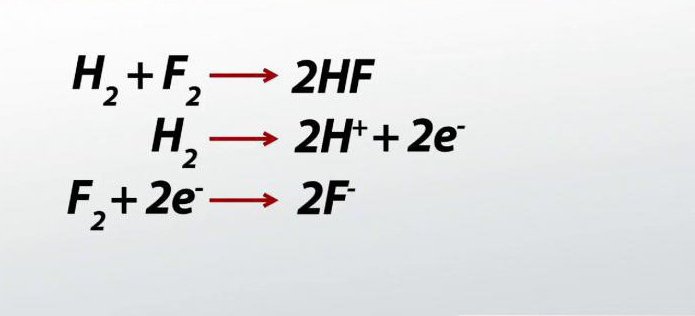
В качестве сильных окислителей можно рассмотреть кислоты, перманганат калия, перекись водорода. Все металлы проявляют восстановительные свойства, превращаясь в реакции в катионы, имеющие положительный заряд.
Заключение
Процессы, касающиеся принятия и отдачи отрицательных электронов, происходят не только в неорганической химии. Обмен веществ, который осуществляется в живых организмах, является наглядным вариантом протекания окислительно-восстановительных реакций в органической химии. Это подтверждает значимость рассмотренных процессов, их актуальность для живой и неживой природы.
Похожие статьи
- Что такое ОВР (химия)? ОВР: примеры и решение
- Окислительно-восстановительный потенциал: расчет и измерение
- Окислительно-восстановительные реакции (ОВР): примеры
- Натрий гипохлорит: формула, применение. Обеззараживание воды гипохлоритом натрия
- Химические и физические свойства неметаллов
- Профессиональная краска для волос «Индола»: палитра, состав и отзывы
- Химическая формула озона
