Оксид серы в природе и жизни человека
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.

Общие данные о моноокисиде серы
Двухвалентный серный монооксид, или иначе серная моноокись – это неорганическое вещество, состоящее из двух простых элементов - серы и кислорода. Формула – SO. В условиях нормальной обстановки является газом без цвета, но с резким и специфическим запахом. Вступает в реакции с водным раствором. Довольно редкое соединение в земной атмосфере. К воздействию температур неустойчив, существует в димерной форме – S2O2. Иногда способен, взаимодействуя с кислородом, в результате реакции образовывать диоксид серы. Солей не образует.
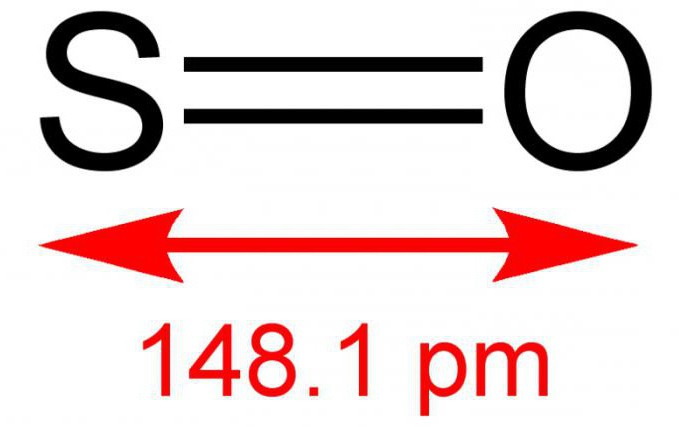
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
- 2S2+O2 = 2SO;
- 2SO2 = 2SO+O2.
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
- S2O2+H2O = H2S2O3.
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.
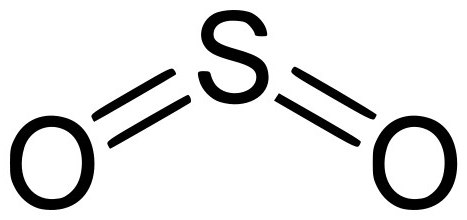
В промышленности получают сжиганием серы или обжигом ее сульфидов:
- 2FeS2+5O2 = 2FeO+4SO2.
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H2SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.

SO2 - довольно токсичное соединение. Характерные симптомы, указывающие на отравление им, - это откашливание, появление проблем с дыханием, как правило, в виде насморка, охриплости, появление необычного привкуса и першение в горле. Вдыхание такого газа может вызвать удушье, нарушение речевой способности индивида, рвоту, затруднение процесса глотания, а также легочный отек в острой форме. Максимально допустимой концентрацией этого вещества в рабочем помещении является 10мг/м3. Однако у различных людей организм может проявлять и разную чувствительность к сернистому газу.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.
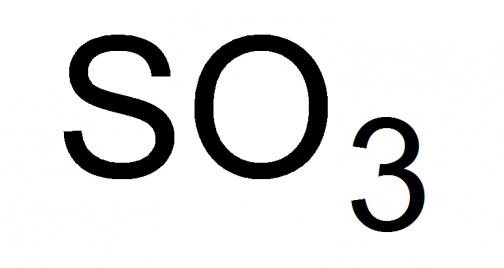
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
- Fe2(SO4)3 = Fe2O3+3SO3;
- SO2+O3 = SO3+O2.
Окисление SO2 при помощи NO2:
- SO2+NO2 = SO3+NO.
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
- 2KHO+SO3 = K2SO4+H2O;
- CaO+SO3 = CaSO4.
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
- SO3+H2O = H2SO4.
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
- SO3+HCl = HSO3Cl.
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
Похожие статьи
- Фосфор и его соединения: степени окисления, формулы
- Химические свойства цинка и его соединений
- Оксид азота: формула, свойства, применение
- Физические свойства сероводорода и его применение
- Диоксид серы: свойства, получение и применение
- Сернистая кислота: что она собой представляет и где применяется?
- Оксид меди (I, II, III): свойства, получение, применение
