Алкины: получение и применение

Уксусная кислота, синтетический каучук, полихлорвинилхлоридные смолы… Что общего может быть между этими соединениями? Оказывается, их всех получают из одного и того же углеводорода – ацетилена, который относится к классу алкинов. Свойства и получение веществ, имеющих тройную связь в молекуле, мы и рассмотрим в нашей статье.
Строение молекулы этина
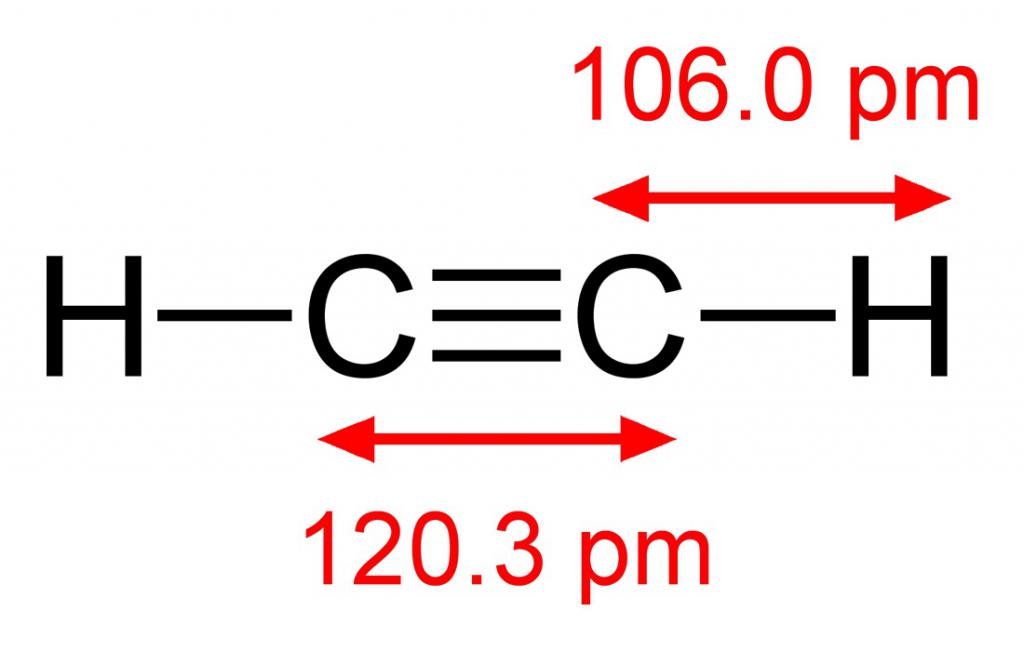
Молекулярная формула C2H2 принадлежит углеводороду, по своим свойствам являющемуся еще более ненасыщенным соединением, чем этилен. Атомы углерода в молекуле ацетилена связаны между собой одной простой и двумя пи-связями. В пространстве они расположены по-разному. Непредельные связи взаимно перпендикулярны друг другу, а сигма-связь находится непосредственно в плоскости молекулы. Такое строение этина, простейшего представителя ненасыщенных соединений, определяет химические свойства и получение алкинов.

Гомологический ряд и физическая характеристика
Общая формула класса изучаемых нами соединений – CH. Она аналогична формуле диеновых углеводородов, являющихся для алкинов изомерами. Названия соединений образуются от соответствующих парафинов заменой суффикса -ан на частицу -ин. Например, бутан – бутин. Первые представители алкинов – газы. С увеличением молекулярной массы температура кипения углеводородов повышается. Так, у ацетилена она составляет -83,8°, а у бутина уже +8,5°. Ацетилен, как простейший алкин, не имеет запаха, он легче, чем воздух, и плохо растворим в воде.
Взрывоопасны смеси газа с воздухом. Если концентрация этина составляет от 2,7% до 80%, они могут воспламениться от искры. Алкины легко горят на воздухе (продукты их жесткого окисления – углекислый газ и вода), процесс сопровождается выделением большого количества энергии. Соединения плохо растворяются в воде, однако, применяя невысокое давление до 15 атм, их можно растворить в ацетоне. Так как ацетилен взрывается от ударов и механических вибраций, в целях соблюдения техники безопасности его сберегают и перевозят в баллонах, содержащих пористые стенки, пропитанные раствором ацетона. В атмосфере с дефицитом кислорода вещества сгорают коптящим пламенем, это происходит за счет частиц углерода, превращающихся в сажу.
Реакции присоединения
Одна из характерных особенностей алкинов – способность притягивать к себе атомы разных элементов. Например, гидрогенизация – насыщение соединения водородными частицами, проходит в условиях повышенной температуры и наличия никелевого катализатора. Продуктами реакции будут различные олефины, а при избытке концентрации водорода – алканы. Например, конечным продуктом гидрирования ацетилена является этан:
C2H2 +2H2 = C2H6
Еще быстрее к ацетилену присоединяются галогены и галогеноводороды. Процесс протекает в два этапа. Одна из таких реакций - взаимодействие с бромной водой, применяется в аналитической химии для распознавания непредельных углеводородов. В результате бурая окраска раствора брома исчезает. Реакции получения алкинов из соответствующих алканов или олефинов являются, по сути, противоположными процессам присоединения. Так, получение этина из этилена можно выразить таким уравнением:
C2H4 = C2H2 + H2
Алкины окисляются и вследствие воздействия на них раствора перманганата калия, имеющего фиолетовый цвет. Под воздействием непредельных связей непредельных углеводородов он обесцвечивается. В продуктах реакции можно обнаружить двухатомный предельный спирт – этиленгликоль.

Принцип Марковникова
Присоединение галогеноводородов по принципу Марковникова к алкинам, получение галогеносодержащих углеводородов нашло широкое применение в химии органического синтеза для добычи разнообразных видов полимерных веществ - смол.
Рассмотрим механизм присоединения на примере реакции гомологов ацетилена с хлороводородом, ведущей к образованию винилхлорида или хлористого винила. Реакция имеет важное промышленное значение, так как полученный продукт служит исходным сырьем для получения полимеров – синтетических смол:
C2H2 + HCl = C2H3Cl – хлористый винил
Например, присоединение бромоводорода к пропину проходит с учетом принципа, открытого российским химиком Н. Марковниковым. Суть его заключается в том, что атом водорода, входящий в состав молекулы HBr, присоединяется к более гидрогенизированной частице углерода при тройной связи, а галоген – к ненасыщенному водородом атому углерода.
Получение алкинов
Так как ацетилен является углеводородом, имеющим наибольшее практическое значение, рассмотрим, каким способом его получают в лабораторных условиях и на химических предприятиях. Карбидный метод является не только самым старым, но и достаточно распространенным способом получения газообразного ацетилена. Главный его недостаток – высокая себестоимость продукта из-за большого расхода электроэнергии. Гидратация карбида кальция является экзотермическим процессом, приводящим к образованию этина:
CaC2 +2 H2O = C2H2 + Ca(OH)2 + Q
Современными и более экономичными являются способы получения алкинов из парафинов, входящих в состав природного и попутных нефтяных газов, содержащих метан. Упрощенно этот процесс можно записать так:
2CH4 = C2H2 + 3H2
При нагревании метан разлагается на смесь различных веществ: не только углерод и водород, но и ацетилен. Чтобы не допустить расщепления молекул этина на простые вещества, соединение быстро удаляют из сферы реакции. Существует еще один процесс получения алкинов – выделение их из компонентов пиролиза нефти.
Значение алкинов
Простейший представитель изучаемых соединений с тройной связью в молекуле – это ацетилен. В смеси с кислородом он до сих пор применяется для резки и сваривания металлов автогенным способом, температура пламени при этом достигает 3150°C. Этин также является основным сырьем для получения важных органических растворителей – трихлорэтана и тетрахлорэтана. Поливинилхлорид, синтезируемый из хлорвинила, идет на изготовление пластмассовых деталей, обладающих химической инертностью и механической прочностью. Полимер также нашел применение для изготовления искусственной кожи и клеенки. Этин является исходным сырьем для синтеза уксусной кислоты – важнейшего многотоннажного органического вещества.

В нашей статье мы рассмотрели основные промышленные способы получения и применения алкинов, а также изучили особенности строения непредельных углеводородов ряда ацетилена.
Похожие статьи
- Химические и физические свойства алкинов
- Как получить этан из метана: уравнение, описание, особенности протекания.
- Получение спиртов, применение, свойства. Способы получения спиртов
- Алканы: общие сведения. Физические и химические свойства алканов
- Гидратация алкенов: реакция и уравнения
- Гомологический ряд химических соединений
- Углеводороды - это соединения углерода с водородом, не содержащие других элементов. Классификация углеводородов
