Химические свойства спиртов одноатомных и многоатомных
Спирты - крупная группа органических химических веществ. Она включает подклассы одноатомных и многоатомных спиртов, а также все вещества комбинированного строения: альдегидоспирты, производные фенола, биологические молекулы. Эти вещества вступают в множество типов реакций как по гидроксильной группе, так и по атому углерода, несущему ее. Эти химические свойства спиртов следует изучить детально.

Виды спиртов
В веществах спиртов содержится гидроксильная группа, присоединенная к несущему углеродному атому. В зависимости от количества атомов углерода, с которыми соединен несущий С, спирты делятся на:
- первичные (соединенные с концевым углеродом);
- вторичные (соединены с одной гидроксильной группой, одним водородом и двумя углеродными атомами);
- третичные (соединены с тремя углеродными атомами и одной гидроксильной группой);
- смешанные (многоатомные спирты, в которых имеются гидроксильные группы у вторичных, первичных или третичных углеродных атомов).
Также спирты делятся в зависимости от количества гидроксильных радикалов на одноатомные и многоатомные. Первые содержат только одну гидроксильную группу у несущего углеродного атома, к примеру, этанол. Многоатомные спирты содержат две и более гидроксильные группы у разных несущих углеродных атомов.
Химические свойства спиртов: таблица
Наиболее удобно подать интересующий нас материал посредством таблицы, которая отражает общие принципы реакционной способности спиртов.
Реакционная связь, тип реакции | Реагент | Продукт |
Связь О-Н, замещение | Активный металл, гидрид активного металла, щелочь или амиды активных металлов | Алкоголяты |
Связь С-О и О-Н, межмолекулярная дегидратация | Спирт при нагревании в кислой среде | Простой эфир |
Связь С-О и О-Н, внутримолекулярная дегидратация | Спирт при нагревании над концентрированной серной кислотой | Непредельный углеводород |
Связь С-О, замещение | Галогеноводород, тионилхлорид, квазифосфониевая соль, галогениды фосфора | Галогеналканы |
Связь С-О - окисление | Доноры кислорода (перманганат калия) с первичным спиртом | Альдегид |
Связь С-О - окисление | Доноры кислорода (перманганат калия) с вторичным спиртом | Кетон |
Молекула спирта | Кислород (горение) | Углекислый газ и вода. |
Реакционная способность спиртов
Благодаря наличию в молекуле одноатомного спирта углеводородного радикала - связи С-О и связи О-Н - данный класс соединений вступает в многочисленные химические реакции. Они определяют химические свойства спиртов и зависят от реакционной способности вещества. Последняя, в свою очередь, зависит от длины углеводородного радикала, присоединенного у несущему углеродному атому. Чем он больше, тем ниже полярность связи О-Н, из-за чего реакции, идущие с отщеплением водорода от спирта, будет протекать медленнее. Это же снижает константу диссоциации упомянутого вещества.
Химические свойства спиртов также зависят от количества гидроксильных групп. Одна смещает электронную плотность на себя вдоль сигма-связей, что увеличивает реакционную способность по О-Н группе. Поскольку это поляризует связь С-О, то реакции с ее разрывом идут активнее у спиртов, у которых имеется две и более О-Н групп. Потому многоатомные спирты, химические свойства которых более многочисленные, охотнее вступают в реакции. Также они содержат несколько спиртовых групп, из-за чего свободно могут вступать в реакции по каждой из них.
Типичные реакции одноатомных и многоатомных спиртов
Типичные химические свойства спиртов проявляются только в реакции с активными металлами, их основаниями и гидридами, кислотами Льюиса. Также типичными являются взаимодействия с галогенводородами, галогенидами фосфора и прочими компонентами с получением галогеналканов. Также спирты являются и слабыми основаниями, потому вступают в реакции с кислотами, образуя при этом галогенводороды и сложные эфиры неорганических кислот.
Простые эфиры образуются из спиртов при межмолекулярной дегидратации. Эти же вещества вступают в реакции дегидрирования с образованием альдегидов из первичного спирта и кетонов из вторичного. Третичные спирты в подобные реакции не вступают. Также химические свойства этилового спирта (и других спиртов) оставляют возможность полного их окисления кислородом. Это простая реакция горения, сопровождающаяся выделением воды с углекислым газом и некоторого количества тепла.

Реакции по атому водорода связи О-Н
Химические свойства одноатомных спиртов допускают разрыв связи О-Н и отщепление водорода. Эти реакции протекают при взаимодействии с активными металлами и их основаниями (щелочами), с гидридами активных металлов, а также с кислотами Льюиса.
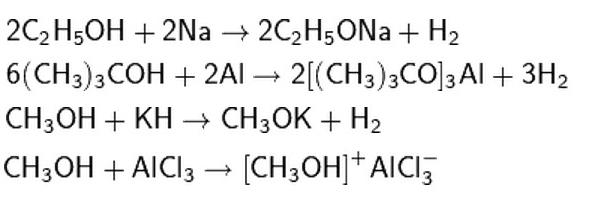
Также спирты активно вступают в реакции со стандартными органическими и неорганическими кислотами. В данном случае продуктов реакции является сложный эфир или галогенуглеводород.
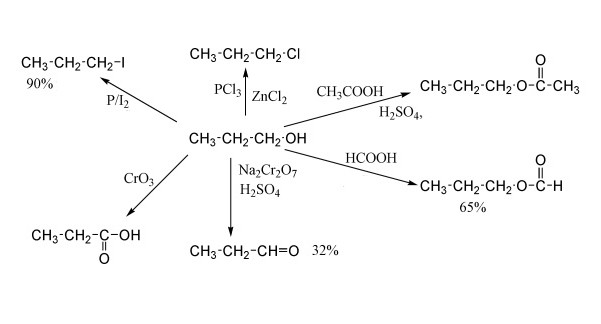
Реакции синтеза галогеналканов (по связи С-О)
Галогеналканы - это типичные соединения, которые могут быть получены из спиртов при протекании нескольких типов химических реакций. В частности, химические свойства одноатомных спиртов позволяют вступать во взаимодействие с галогенводородами, с галогенидами трех- и пятивалентного фосфора, квазифосфониевыми солями, тионилхлоридом. Также галогеналканы из спиртов могут быть получены промежуточным путем, то есть синтезом алкилсульфоната, который позже вступит в реакцию замещения.
Пример первой реакции с галогенводородом указан на графическом приложении выше. Здесь бутиловый спирт реагирует с хлоридом водорода с образованием хлорбутана. В общем, класс соединений, содержащих хлор и углеводородный насыщенный радикал, называется алкилхлоридом. Побочным продуктом химического взаимодействия является вода.
Реакции с получением алкилхлорида (йодида, бромида или фторида) достаточно многочисленные. Типичный пример - взаимодействие с трибромидом фосфора, пентахлоридом фосфора и прочими соединениями данного элемента и его галогенидов, перхлоридов и перфторидов. Они протекают по механизму нуклеофильного замещения. С тионилхлоридом спирты реагируют также с образованием хлоралкана и выделением SO2.
Наглядно химические свойства одноатомных предельных спиртов, содержащих насыщенный углеводородный радикал, представлены в виде реакций на иллюстрации ниже.
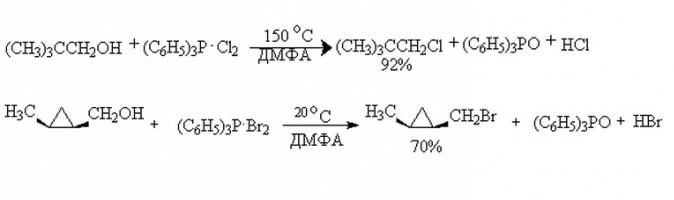
Спирты легко взаимодействуют с квазифосфониевой солью. Однако данная реакция наиболее выгодна при протекании у одноатомных вторичных и третичных спиртов. Они региоселективны, позволяют "имплантировать" галогеновую группу в строго определенное место. Продукты таких реакций получаются с высокой массовой долей выхода. А многоатомные спирты, химические свойства которых несколько отличаются от таковых у одноатомных, могут изомеризоваться в ходе реакции. Потому получение целевого продукта затрудняется. Пример реакции на изображении.
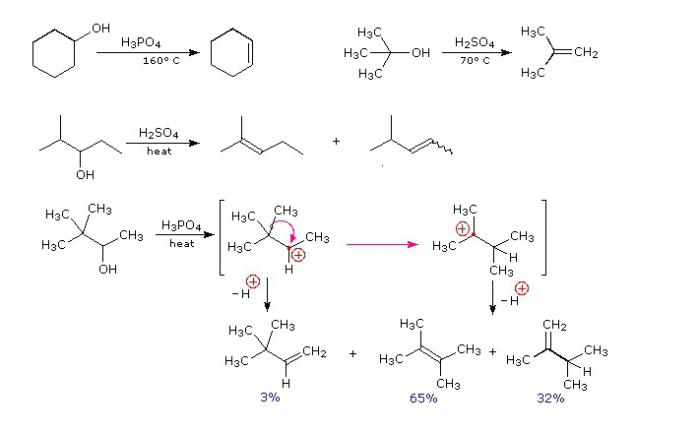
Внутримолекулярная и межмолекулярная дегидратация спиртов
Гидроксильная группа, расположенная у несущего углеродного атома, может отщепляться при помощи сильных акцепторов. Так протекают реакции межмолекулярной дегидратации. При взаимодействии одной молекулы спирта с другой в растворе концентрированной серной кислоты молекула воды отщепляется от обеих гидроксильных групп, радикалы которых соединяются в молекулу простого эфира. При межмолекулярной дегидратации этаналя можно получить диоксан - продукт дегидратации по четырем гидроксильным группам.
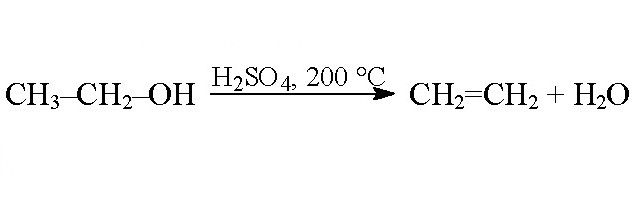
При внутримолекулярной дегидратации продуктом является алкен.
Похожие статьи
- Получение спиртов, применение, свойства. Способы получения спиртов
- Этиловый спирт. Спирт этиловый медицинский - применение
- Одноатомные спирты. Как получить предельный одноатомный спирт
- Альдегиды и кетоны. Формула, получение, применение
- Метанол: действие на организм человека при вдыхании
- Гидратация алкенов: реакция и уравнения
- Что такое алкоголь? Производство и употребление алкоголя. Влияние алкоголя на организм
