Химические свойства карбоновых кислот и методы получения
Химические соединения, которые состоят в том числе и из карбоксильной группы COOH, получили от ученых название карбоновые кислоты. Существует большое количество наименований этих соединений. Они классифицируются по разным параметрам, например, по количеству функциональных групп, наличию ароматического кольца и так далее.
Строение карбоновых кислот
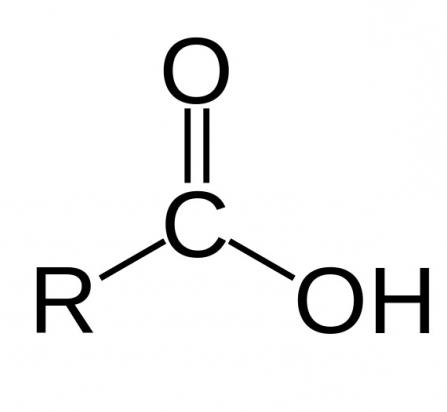
Как уже упоминалось, для того чтобы кислота была карбоновой, она должна иметь карбоксильную группу, которая, в свою очередь, имеет две функциональные части: гидроксил и карбонил. Их взаимодействие обеспечивается ее функциональным сочетанием одного атома углерода с двумя кислородными. Химические свойства карбоновых кислот зависят от того, какое строение имеет эта группа.
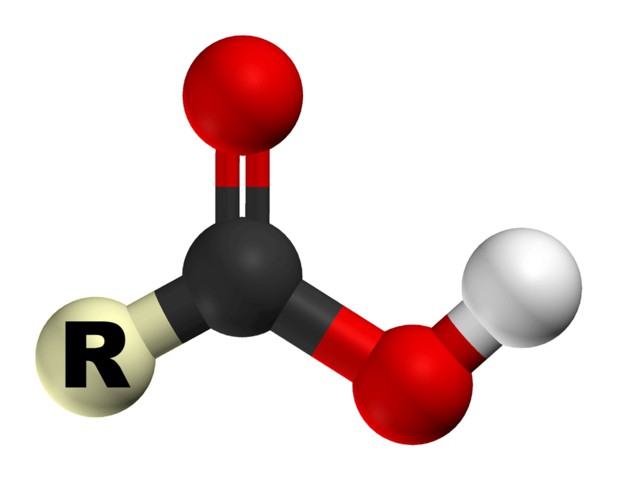
За счет карбоксильной группы эти органические соединения можно называть кислотами. Их свойства обуславливаются повышенной способностью иона водорода H+ притягиваться к кислороду, дополнительно поляризуя связь O-H. Также благодаря этому свойству органические кислоты способны диссоциировать в водных растворах. Способность к растворению уменьшается обратно пропорционально росту молекулярной массы кислоты.
Разновидности карбоновых кислот
Химики выделяют несколько групп органических кислот.
Классификация карбоновых кислот | |
По числу функциональных групп | Монокарбоновые |
Дикарбоновые | |
Поликарбоновые | |
По природе радикала | Алифатические |
Ароматические | |
Циклические | |
По степени насыщенности радикала | Ненасыщенные |
Насыщенные | |
По наличию функциональных групп в радикале, то есть по замещению одного атома водорода | Галоген (Cl2, F2, Br2, I2) |
Оксогруппу (COH) | |
Оксигруппу (OH) | |
Аминогруппу (NH2) | |
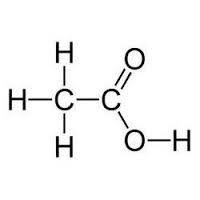
Моноосновные карбоновые кислоты состоят из углеродного скелета и только одной функциональной карбоксильной группы. Каждый школьник знает химические свойства карбоновых кислот. 10 класс учебной программы по химии включает в себя непосредственно изучение свойств одноосновных кислот. Двухосновные и многоосновные кислоты имеют в своей структуре две и более карбоксильных групп соответственно.
Также по наличию или отсутствию двойных и тройных связей в молекуле бывают ненасыщенные и насыщенные карбоновые кислоты. Химические свойства и их отличия будут рассмотрены ниже.
Если органическая кислота имеет в составе радикала замещенный атом, то в ее название включается наименование группы-заместителя. Так, если атом водорода замещен галогеном, то в названии кислоты будет присутствовать наименование галогена. Такие же изменения претерпит наименование, если произойдет замещение на альдегидную, гидроксильную или аминогруппы.
Изомерия органических карбоновых кислот
Практически все органические вещества имеют способность к изомеризации. Карбоновые кислоты не исключение. Выделяют следующие виды изомерии:
- Углеродного скелета.
- Межклассовая изомерия.
- Пространственная изомерия;
Возможность изомеризироваться напрямую влияет на химические свойства карбоновых кислот.
Изомерия скелета возможна для кислот, чей углеводородный радикал содержит не менее четырех атомов углерода. Межклассовая, в свою очередь, возможна для кислот с двумя углеродными атомами в радикале. А к пространственной способны карбоновые кислоты только с одинарными связями в скелете.
Перечень и важнейшие карбоновые кислоты
Названия и формулы известных карбоновых кислот | ||
Систематическое название кислоты | Тривиальное наименование | Формула карбоновой кислоты |
Метановая кислота | Муравьиная | HCOOH |
Этановая кислота | Уксусная | CH2COOH |
Пропановая кислота | Пропионовая | CH3CH2COOH |
Бутановая кислота | Масляная | CH3CH2CH2COOH |
Пентановая кислота | Валериановая | CH3CH2CH2CH2COOH |
Пентеновая кислота | Акриловая | CH2=CH-COOH |
Бензолкарбоновая кислота | Бензойная | C6H5COOH |
Гексадекановая | Пальмитиновая | C15H31COOH |
Оксодекановая | Стеариновая | C17H35COOH |
Этандиовая | Щавелевая | HOOC-COOH |
Пропандиовая | Малоновая | HOOC-CH2-COOH |
Бутандиовая | Янтарная | HOOC-CH2-CH2-COOH |
Бензолдикарбоновая | Фталевая | HOOC-C6H5-COOH |
2-гидрокси-пропановая кислота | Молочная | CH3CHOHCOOH |
Гидроксибутандиовая кислота | Яблочная | HOOC-CH2CHOH-COOH |
2,3-дигидроксибутандиовая кислота | Винная | HOOC-OHCH-OHCH-COOH |
3-карбокси-3-гидроксипентандиовая | Лимонная | HOOC-CH2-CHOH-COOH-CH2COOH |
2-оксопропановая кислота | Пировиноградная | CH3COCOOH |
2-гидроксибензойная кислота | Салициловая | C6H5OHCOOH |
Карбоновые кислоты: химические свойства
Для более детального понимания сути карбоновых кислот рассмотрим их свойства. В школьной программе в большом объеме рассматриваются одноосновные карбоновые кислоты, химические свойства которых проявляются в реакциях между галогенводородами, водой и другими веществами. Все такого рода кислоты:
- Диссоциируют в растворе на ионы водорода и радикал с карбоксилом. При этом муравьиная кислота относится к электролитам средней силы, а уксусная слабым, то есть сила диссоциации уменьшается вниз по гомологическому ряду.
- Окрашивают лакмусовую бумажку в красный цвет.
- Проводят ток электричества.
- Реагируют с галогенами: 2RCOOH+Cl2=2RCOOCl+2HCL.
- Вступают в реакцию этерификации со спиртами: R-COOH+R'OH=RCOOR'+H2O.
- Взаимодействуют с некоторыми металлами: RCOOH+Mg=RCOOMg+H2.
- Реагируют с оксидами основного типа и гидроксидами, образуя соли: RCOOH+NaOH=RCOONa+H2O.
- Вступают в реакции с солями: RCOOH+Na2CO3=RCOONa+H2O+CO2.
Такие свойства одноосновных кислот объясняются изменением карбоксильной группы, от гидроксила которой осуществляется сдвиг электронов на ближайший атом углерода, частично гася его положительный заряд. Кроме этого, карбоновые кислоты, химические свойства которых описаны выше, обладают двухсторонним взаимодействием между атомами.
Химические свойства других одноосновных кислот
Из классификации известно, что бывают и одноосновные непредельные карбоновые кислоты, химические свойства которых отличаются от таковых у предельных.
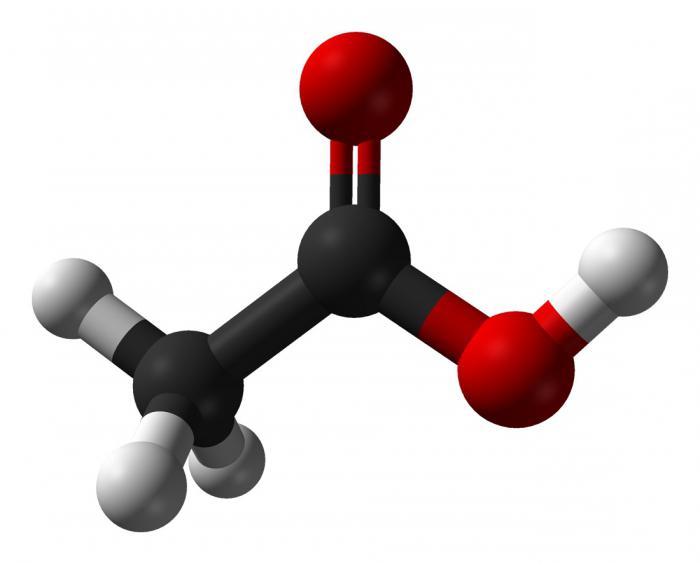
Итак, кислоты с двойной связью в углеводородном радикале - одноосновные непредельные карбоновые кислоты. Химические свойства таких кислот выражаются в реакциях:
- С галогенводородом, но гораздо медленнее предельных и вопреки правилу Марковникова, так как карбоксильная группа уменьшает электронную плотность двойной связи: R=CH-COOH+HCl = RCl-CH2-COOH.
- С галогенами: Br2+R=CH-COOH = RBr-CHBr-COOH.
- С водородом, в результате чего рвется двойная связь: H2+R=CH-COOH = COOH-R-CH.
- Осторожное окисление, в результате которого образуются оксикислоты: R=CH-COOH+H2O [O] R(OH)-CH(OH)COOH.
- Радикальное окисление, происходящее с разрывом молекулы кислоты (на примере пропеновой кислоты): CH3-CH=C-COOH+H2O [O] CH3COOH+HOOC-COOH.
- Полимеризации: n COOH-(CH=CH)-R = n(-COOH-CH-CH-R-)
Химические свойства двукарбоновых кислот
Дикарбоновые органические кислоты - это двухосновные карбоновые кислоты. Химические свойства таких кислот отличаются от свойств монокарбоновых. Это объясняется тем, что сила двухосновных кислот больше силы моноосновных из-за влияния второй группы из карбоксила и гидроксила. Притом это влияние уменьшается по мере удаления от цепи атомов углерода.
Двухосновные кислоты проявляют следующие свойства:
- Декарбоксилирование кислот (на примере этандиновой): HOOC-COOH (t)= HOOC+CO2. Важно знать, что щавелевая и малоновые кислоты подвергаются декарбоксилированию гораздо проще, чем остальные.
- Образование кислых и средних солей: HOOC-R-R-COOK или HOOK-R-R-COOK.
- Образование полных и неполных эфиров.
- Малоновая кислота способна вступать в реакции замещения: водород из CH2-группы углеводородного радикала легко замещается на атомы металлов.
Соли, образуемые карбоновыми кислотами
Соли - это органические соединения, образующиеся в результате замещения атома водорода и гидроксила карбоксильной группы карбоновой кислоты на металл. То есть органические кислоты в реакциях с основаниями или неорганическими солями способны образовать соли карбоновых кислот. Химические свойства, благодаря которым получаются такие органические соединения как соли, применяются в бытовой промышленности для производства мыла.
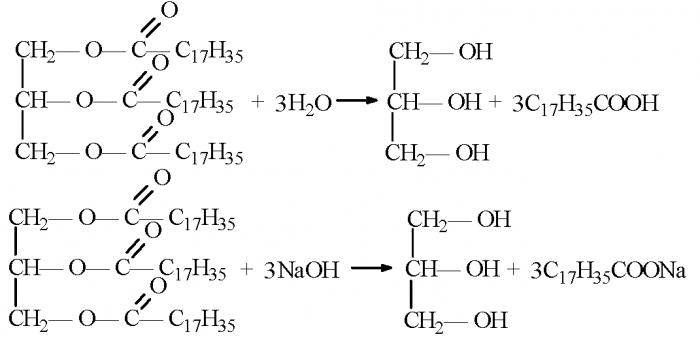
Наиболее подходящими для синтеза твердого и жидкого мыла являются стеариновая (октадекановая) и пальмитиновая (гексадекановая) кислоты. Также нередко применяются олеиновая (цис-9-октадеценовая) или миристиновая (тетрадекановая кислота) кислота.
В основе получения мыла лежит реакция синтеза сложных эфиров вышеперечисленных кислот с калиевой или натриевой солью.
Способы получения карбоновых кислот
Способов и методов получения кислот с группой COOH существует множество, но наиболее часто применяются следующие:
- Выделение из природных веществ (жиров и прочего).
- Окисление моноспиртов или соединений с COH-группой (альдегидов): ROH (RCOH) [O] R-COOH.
- Гидролиз тригалогеналканов в щелочи с промежуточным получением моноспирта: RCl3 +NaOH=(ROH+3NaCl)=RCOOH+H2O.
- Омыление или гидролиз эфиров кислоты и спирта (сложных эфиров): R−COOR'+NaOH=(R−COONa+R'OH)=R−COOH+NaCl.
- Окисление алканов перманганатом (жесткое окисление): R=CH2 [O], (KMnO4) RCOOH.
Значение карбоновых кислот для человека и промышленности

Химические свойства карбоновых кислот имеют большое значение для жизнедеятельности человека. Они чрезвычайно необходимы для организма, так как в большом количестве содержатся в каждой клетке. Метаболизм жиров, белков и углеводов всегда проходит через стадию, на которой получается та или иная карбоновая кислота.
Кроме того, карбоновые кислоты используют при создании лекарственных препаратов. Ни одна фармацевтическая промышленность не может существовать без применения на деле свойств органических кислот.

Немаловажную роль соединения с карбоксильной группой играют и в косметической промышленности. Синтез жира для последующего изготовления мыла, моющих средств и бытовой химии основан на реакции этерификации с карбоновой кислотой.
Химические свойства карбоновых кислот находят отражение в жизнедеятельности человека. Они имеют большое значение для человеческого организма, так как в большом количестве содержатся в каждой клетке. Метаболизм жиров, белков и углеводов всегда проходит через стадию, на которой получается та или иная карбоновая кислота.
Похожие статьи
- Химические свойства спиртов одноатомных и многоатомных
- Азелаиновая кислота: действие на кожу, препараты, показания и побочные эффекты, отзывы
- 20 аминокислот: названия, формулы, значение. Аланин, валин, серин, лизин, пролин, тирозин
- Карболовая кислота: химические свойства, области применения
- Уксусный альдегид: свойства, получение, применение
- Что такое жиры? Определение, формула, классификация, свойства
- Уксусная кислота: химическая формула, свойства и применение
